撰文:高铭凰
脑膜淋巴管位于硬脑膜内,沿硬脑膜中动脉绕行,最终与颈静脉相伴,经颅底裂孔离开大脑( 图1 )。目前研究发现,脑膜淋巴管是中枢神经系统与外周淋巴管沟通的关键通道,可将脑脊液中的大分子蛋白、免疫细胞和代谢产物以CCL21/C-C趋化因子受体7型依赖的方式引流至外周淋巴系统[1, 2]。大脑免疫系统主要由脑实质驻留的小胶质细胞和边界免疫细胞(包括硬脑膜内的髓系细胞和淋巴细胞)组成,形成中枢神经系统严密的免疫网络[3]。大脑边界免疫细胞涵盖了边界相关巨噬细胞、树突状细胞、T细胞、B细胞、单核细胞、中性粒细胞、自然杀伤细胞和先天类淋巴细胞等多种免疫细胞群体[4-6],具有独特的地理位置和细胞多样性,从而构成一个动态的免疫生态位( 图2 )。这些免疫细胞群体分泌多种细胞因子到脑脊液,并扩散到脑实质,从而影响特定的神经元亚群而产生不同的行为反应及疾病应对方式。与此同时,这些免疫细胞群影响与中枢神经系统相关的免疫反应,并随着年龄的增长而改变,导致一系列炎症和神经退行性疾病。因此,探究脑膜淋巴管与中枢神经系统免疫细胞之间的交流对进一步探索脑膜淋巴管在在神经退行性疾病的组织生理学和病理学中的作用具有重要意义。
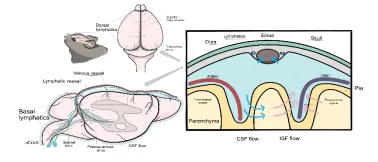
图1脑膜淋巴囊泡及脑脊液和脑间质液引流途径
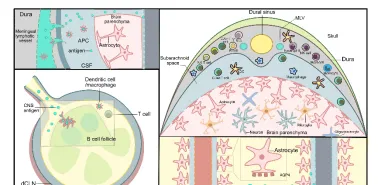
图2脑膜内的免疫概况和中枢神经系统抗体递送途径
最近来自中国广州中医药大学王奇团队在【中国神经再生研究(英文版)】(Neural Regeneration Research)上发表了题为「 Meningeal lymphatic vessel crosstalk with central nervous system immune cells in aging and neurodegenerative diseases 」的综述。该文概述了脑膜淋巴管在中枢神经系统免疫网络中的多方面作用,探讨了中枢神经系统稳态和神经退行性疾病病理中脑膜淋巴管与免疫细胞之间的串扰作用。该文提出了在衰老和神经退行性疾病中,脑膜淋巴管结构和功能的调控可能会影响淋巴引流、脑脊液中的免疫神经调节因子和免疫细胞群,从而在塑造脑膜和脑实质免疫中发挥关键作用的观点。
最初人们认为脑膜淋巴管只是大脑一条「排泄垃圾」的通道,但现在人们已经清楚,脑膜淋巴管与中枢神经系统免疫细胞共同形成并维持了一个紧密交织的脑膜淋巴-免疫网络,这是中枢神经系统免疫功能充分发挥的一个重要前提。通过脑膜淋巴管提供的通讯途径,脑膜免疫细胞可以在脑脊液和外周免疫系统之间进行迁移,外周免疫系统可以从引流的脑脊液中采集到大脑代谢信号进行免疫反应。与此同时,脑膜来源的细胞因子通过胶质淋巴系统的血管旁内流进入脑实质直接影响神经细胞,调控大脑内稳态和病理反应。因此,当脑膜淋巴管损伤时,经脑膜淋巴管联通的细胞因子也会受到影响,这可能与细胞因子分泌失衡及脑内毒性分子堆积相关[1, 7]。
髓系细胞作为一类异质性的先天性免疫细胞,在中枢神经系统发育和成年过程中对维持中枢神经系统的平衡发挥着重要作用;这些髓系细胞包括实质小胶质细胞和非实质巨噬细胞,如软脑膜巨噬细胞、血管周围巨噬细胞和脉络丛巨噬细胞,以及树突细胞和单核细胞的各种亚群[8]。
脑淋巴内皮细胞和小胶质细胞之间的串扰关系在中枢神经系统定植早期就已初见苗头并在中枢神经系统健康和疾病中发挥着重要作用。脑边界淋巴管是MRC1/Mrc1小胶质细胞前体在胚胎斑马鱼大脑中早期定殖的中心位置,这与传统的pu1阳性卵黄囊来源的小胶质细胞谱系定殖位置并不一致[9]。因此,最早的MRC1/Mrc1小胶质细胞前体可能起源于或依赖于大脑淋巴内皮细胞。但值得注意的是,这些脑淋巴内皮细胞仅来自斑马鱼淋早期淋巴内皮细胞的群体,而不是来自小鼠的淋巴管内皮细胞,这值得进一步研究讨论。此外研究发现,在成熟的中枢神经系统中,小胶质细胞可与淋巴管内皮细胞协同清除脑代谢产物,淋巴管内皮细胞主要对可溶性大分子和较小颗粒具有内吞作用(包括蛋白质、多糖和较小的底物,如人类乳头瘤病毒等),而小胶质细胞可能专门吸收较大的颗粒和病原体[10]。因此,虽然具体的交换机制和途径尚未明确,但科学家们已经认识到小胶质细胞可通过调节旁分泌信号在中枢神经系统功能和疾病行为中发挥重要作用。脑膜淋巴管作为一个重要的免疫引流途径,可能可以通过改变分泌信号的可及性及及时性,从而调控大脑细胞的反应[11]。与此同时,中枢神经系统中的巨噬细胞、树突细胞等免疫细胞以及星形胶质细胞和血管内皮细胞等神经系统细胞也可通过分泌白细胞介素和血管内皮生长因子等可溶性介质重塑脑膜淋巴管的结构和功能[12, 13]。树突细胞和巨噬细胞等中枢神经系统抗原呈递细胞受淋巴管内皮细胞表达的蛋白调控,包括CCL21、CCL27、1-磷酸鞘磷脂、集落刺激因子1、血管细胞粘附分子1和细胞间粘附分子1等[14],这有助于中枢神经系统抗原的传递以激活外周免疫细胞并进一步迁移到中枢。因此,脑膜淋巴管在呈递中枢抗原到外周颈部淋巴结的过程中发挥了关键作用,这有助于中枢神经系统免疫与外周免疫中建立紧密联系。
在稳态条件下,B细胞在中枢神经系统实质和脑脊液白细胞总数占比中不到 1%[15];在硬脑膜内占比约为 30%[16]。而病理状态下时,硬脑膜中B细胞会形成淋巴滤泡样结构,从而在中枢神经系统中产生持续的免疫病理反应[17, 18]。研究人员利用单细胞RNA测序技术,检测到骨髓来源的不同时期B细胞(包括幼稚B细胞、过渡B细胞、成熟B细胞)同时存在于稳态的硬脑膜[19]。因此推测早期B系祖细胞可能在发育早期就已经迁移到中枢神经系统中定殖,并在局部发育与成熟。但目前关于脑膜B细胞是来源于颅内骨髓薄层中的祖细胞库,还是直接来源于硬脑膜中独立于骨髓的祖细胞的研究尚无定论[20]。这并不妨碍这是一个有趣的发现,因为这些发育中的B细胞在硬脑膜中这一特殊的起源与发育位置可能有助于它们识别并建立针对中枢神经系统抗原的自身性免疫耐受。然而,随着年龄的增长,从外周浸润而来的累积的年龄相关 B 细胞和浆细胞占据了脑膜中发现的大多数种群[19],这导致了神经退行性疾病和神经系统自身免疫性疾病的高发病率,这与在老年小鼠发现的脑膜淋巴管出现的功能障碍的时间轴相一致。除了颅骨骨髓内的细胞库外,淋巴细胞的另一个补充来源是外周免疫系统中的颈深淋巴结。颈部淋巴结已被验证在维持T细胞亚群汇集及经脑膜淋巴管为中枢神经系统抗原与淋巴细胞相遇提供激活空间的方面发挥着重要作用[19]。稳态情况下,脑膜淋巴管为脑源性抗原引流至颈深淋巴结提供了一个直接通道,进一步补充了机体对中枢神经系统抗原的自身免疫耐受[21]。因此,脑膜淋巴管为独立于骨髓和胸腺之外的脑源性免疫抗原完善补充了自身免疫耐受途径,这有助于维持中枢神经系统免疫豁免。而当衰老或神经系统疾病导致脑膜淋巴管功能失调时,这种免疫豁免就会被打破,引起中枢神经系统免疫功能失调。
除了在完善自身免疫耐受中发挥作用,脑膜淋巴管对促进淋巴T细胞与中枢神经细胞之间的沟通中也发挥着重要作用。研究发现,脑源性抗原经脑膜淋巴管引流至外周颈深淋巴结后会引起T细胞激活,在CCL21趋化因子的作用下经脑膜淋巴管向大脑迁移[22],在脑实质病灶部位与同源性抗原再次相遇后进一步活化发挥效应作用[23]。因此,脑膜淋巴引流是脑源性T细胞形成与迁移的必要调减。此外,脑膜淋巴管为T细胞与小胶质细胞和神经元等实质胶质细胞连接和沟通的提供了重要途径。一般来说,小胶质细胞和T细胞在中枢神经系统发育和内稳态中各自起着重要作用;而在病理情况下,激活的小胶质细胞和/或巨噬细胞可能与经脑膜淋巴管出入脑实质中的脑源性T细胞的相遇,从而增强了它们加剧损伤的能力,导致神经炎症和神经病理的恶化。因此,靶向调控脑膜淋巴管可能是调节大脑免疫反应的重要途径。
在神经退行性疾病中,常常会出现血管炎症、血脑屏障功能受损、蛋白质沉积异常和脑膜淋巴系统引流的病理变化。如研究发现在老龄人群中,胶状淋巴系统和淋巴系统都出现了结构与功能损伤,伴随脑内间质液和代谢产物堆积于扩张的血管旁间隙中,造成脉动的振幅减缓并引起神经毒性蛋白在脑实质中积累,从而引起或加重神经退行性疾病病理改变[24]。此外,在脑膜RNA测序分析中发现老龄化小鼠的淋巴管内皮细胞基因与幼龄小鼠淋巴管内皮细胞基因谱在免疫、炎症、细胞粘附等方面具有明显差异,说明了淋巴管功能随着年龄递增而出现了功能的减退[1]。脑膜淋巴管功能的损伤进一步引起神经递质、趋化因子、抗原等大脑细胞分泌的不同信号的紊乱,导致大脑内白细胞浸润及神经系统功能紊乱[25]。因此,调控脑膜淋巴管在一定程度上可以促进或限制衰老和神经退行性疾病的发病机制,成为神经炎症和神经退行性疾病的关键调节靶点。
阿尔茨海默病以淀粉样蛋白β沉淀和神经纤维缠结为主要病理特征,伴随突触功能障碍和神经元死亡[26]。研究发现在衰老与阿尔茨海默病疾病模型中,脑膜淋巴管功能损伤加重了神经毒性蛋白沉积[27],引起脑脊液灌注损伤[28],加重学习和记忆障碍[29]。此外,先天性免疫反应中小胶质细胞的激活、补体成分和趋化因子分泌紊乱在阿尔茨海默氏病早期就被发现[30],适应性免疫反应中T细胞在脑内的浸润对老年斑负荷的加重[31]和加快神经变性[32]等均有研究报道。因此,脑膜淋巴管有助于清除病理性蛋白的沉积和改善免疫系统紊乱,为阿尔茨海默病提供了一种潜在的治疗方法。自身免疫性脑脊髓炎是一种神经脱髓鞘退化性疾病,其特征是来自循环的单核细胞来源的巨噬细胞和T细胞的浸润及小胶质细胞的激活[33]。在疾病进程中,自身抗原反应性T淋巴细胞T细胞迁移到中枢神经系统从而引发炎症级联反应。此外脊髓炎患者硬脑膜中发现卵泡样淋巴结构(含B细胞、浆细胞、T细胞和树突状细胞)[34],提示了脑膜是疾病进程中一个重要免疫反应区域。考虑到脑膜淋巴管在连接中枢与外周免疫细胞迁移中的通道作用,研究人员在在自身免疫性脑脊髓炎小鼠模型中评估了脑膜淋巴功能障碍和免疫细胞失调之间的关系,发现脑膜淋巴管在疾病进展期间淋巴T细胞在硬脑膜中的聚集和向大脑中的迁移过程中发挥着重要作用[3],而阻断脑膜淋巴管功能可以降低脑源性T细胞的数量,减轻炎症反应,延缓疾病进程。帕金森病以运动异常和认知障碍为主要临床特征,主要病理表现为细胞内α-突触核蛋白(「路易小体」)聚集。研究发现帕金森患者脑膜淋巴管脑脊液灌注明显减少,颈淋巴结淋巴液灌注出现延迟,这为帕金森患者脑膜淋巴管功能下降提供了临床证据[35]。在转基因小鼠中α-突触核蛋白沉积程度与脑淋巴流量成反比,阻断淋巴引流后病理程度加重[36],这支持了脑膜淋巴管在帕金森病中的重要引流作用。除了脑内常驻的小胶质细胞激活外,患者脑脊液与脑实质中活化T细胞和B细胞水平也出现了增高[37]。这些激活的T细胞或者免疫球蛋白在多巴胺能神经元和路易小体周围的聚集,提示了免疫细胞的紊乱与神经元功能的丧失密切相关[38, 39]。因此大脑神经毒性蛋白沉积伴随免疫细胞紊乱与脑膜淋巴管功能密切相关,脑膜淋巴管为帕金森靶向治疗提供了一个潜在的途径。
王奇等提出,脑膜淋巴管可将脑脊液中的代谢物、细胞碎片和大分子蛋白质排入外周淋巴系统,维持中枢神经系统的稳态及功能[40, 41];另一方面,脑膜淋巴管协助中枢神经系统的免疫反应,联通外周免疫细胞和中枢神经系统免疫细胞进而在调控大脑的病理反应。文末作者提出了关于脑膜淋巴管进一步研究的4个具体方向:(1)脑膜淋巴管利用了哪些分子与中枢神经系统免疫细胞进行交流,串扰的具体机制是什么?(2)如何以及在多大程度上调控脑膜淋巴管的可塑性可以达到治疗目的?(3)中枢神经系统通过脑膜淋巴管诱导中枢神经系统边界免疫细胞的迁移以及新鲜免疫细胞(如来自颅骨骨髓或外周淋巴结的免疫细胞)的生成和更新以补充减少的免疫细胞群的具体机制是什么?(4)中枢神经系统免疫如何在稳态或各种神经系统疾病中间调节多核淋巴细胞的功能和形态,及硬脑膜中免疫细胞的动态变化是否会影响脑膜淋巴管的结构与功能?除此之外,遗传、血管、环境和生活方式等因素如何在自然衰老和神经系统疾病中影响脑膜淋巴管的结构功能也是另一个非常值得研究的方向。因此,虽然作者在这篇综述中只讨论了脑膜淋巴管与中枢神经系统免疫系统之间的关系,但考虑到其复杂性和异质性,脑膜淋巴应与其他病理因素结合起来作为治疗靶点,以期预防、阻止并尝试逆转神经退行性疾病的临床过程。
原文链接:https://doi.org/10.4103/NRR.NRR-D-23-01595
参考文献
[1] Da Mesquita S, Fu Z, Kipnis J. The meningeal lymphatic system: a new player in neurophysiology. Neuron. 2018;100(2):375-388.
[2] Eide PK, Vatnehol SaS, Emblem KE, et al. Magnetic resonance imaging provides evidence of glymphatic drainage from human brain to cervical lymph nodes. Sci Rep. 2018;8(1):7194.
[3] Louveau A, Herz J, Alme MN, et al. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature. Nat Neurosci. 2018;21(10):1380-1391.
[4] Raper D, Louveau A, Kipnis J. How do meningeal lymphatic vessels drain the CNS? Trends Neurosci. 2016;39(9):581-586.
[5] Escobedo N, Oliver G. Lymphangiogenesis: origin, specification, and cell fate determination. Annu Rev Cell Dev Biol. 2016;32:677-691.
[6] Kim H, Kataru RP, Koh GY. Inflammation-associated lymphangiogenesis: a double-edged sword? J Clin Invest. 2014;124(3):936-942.
[7] Da Mesquita S, Louveau A, Vaccari A, et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature. 2018;560(7717):185-191.
[8] Kumaravelu P, Hook L, Morrison AM, et al. Quantitative developmental anatomy of definitive haematopoietic stem cells/long-term repopulating units (HSC/RUs): role of the aorta-gonad-mesonephros (AGM) region and the yolk sac in colonisation of the mouse embryonic liver. Development. 2002;129(21):4891-4899.
[9] Green LA, O'dea MR, Hoover CA, et al. The embryonic zebrafish brain is seeded by a lymphatic-dependent population of mrc1(+) microglia precursors. Nat Neurosci. 2022;25(7):849-864.
[10] Huisman Y, Uphoff K, Berger M, et al. Meningeal lymphatic endothelial cells fulfill scavenger endothelial cell function and cooperate with microglia in waste removal from the brain. Glia. 2022;70(1):35-49.
[11] Dantzer R. Neuroimmune interactions: from the brain to the immune system and vice versa. Physiol Rev. 2018;98(1):477-504.
[12] Laurenti E, Göttgens B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 2018;553(7689):418-426.
[13] Bower NI, Koltowska K, Pichol-Thievend C, et al. Mural lymphatic endothelial cells regulate meningeal angiogenesis in the zebrafish. Nat Neurosci. 2017;20(6):774-783.
[14] Korin B, Ben-Shaanan TL, Schiller M, et al. High-dimensional, single-cell characterization of the brain's immune compartment. Nat Neurosci. 2017;20(9):1300-1309.
[15] Magliozzi R, Columba-Cabezas S, Serafini B, et al. Intracerebral expression of CXCL13 and BAFF is accompanied by formation of lymphoid follicle-like structures in the meninges of mice with relapsing experimental autoimmune encephalomyelitis. J Neuroimmunol. 2004;148(1-2):11-23.
[16] Serafini B, Rosicarelli B, Magliozzi R, et al. Detection of ectopic B-cell follicles with germinal centers in the meninges of patients with secondary progressive multiple sclerosis. Brain Pathol. 2004;14(2):164-174.
[17] Keren-Shaul H, Spinrad A, Weiner A, et al. A unique microglia type associated with restricting development of Alzheimer's disease. Cell. 2017;169:1276-1290.e17(7).
[18] Wang Y, Chen D, Xu D, et al. Early developing B cells undergo negative selection by central nervous system-specific antigens in the meninges. Immunity. 2021;54:2784-2794.e6(12).
[19] Schafflick D, Wolbert J, Heming M, et al. Single-cell profiling of CNS border compartment leukocytes reveals that B cells and their progenitors reside in non-diseased meninges. Nat Neurosci. 2021;24(9):1225-1234.
[20] Engelhardt B, Ransohoff RM. The ins and outs of T-lymphocyte trafficking to the CNS: anatomical sites and molecular mechanisms. Trends Immunol. 2005;26(9):485-495.
[21] Guldner IH, Wyss-Coray T. Activated immune cells drive neurodegeneration in an Alzheimer's model. Nature. 2023;615(7953):588-589.
[22] Förster R, Davalos-Misslitz AC, Rot A. CCR7 and its ligands: balancing immunity and tolerance. Nat Rev Immunol. 2008;8(5):362-371.
[23] Schläger C, Körner H, Krueger M, et al. Effector T-cell trafficking between the leptomeninges and the cerebrospinal fluid. Nature. 2016;530(7590):349-353.
[24] Zhou Y, Cai J, Zhang W, et al. Impairment of the glymphatic pathway and putative meningeal lymphatic vessels in the aging human. Ann Neurol. 2020;87(3):357-369.
[25] Chen X, Holtzman DM. Emerging roles of innate and adaptive immunity in Alzheimer's disease. Immunity. 2022;55(12):2236-2254.
[26] Butterfield DA, Halliwell B. Oxidative stress, dysfunctional glucose metabolism and Alzheimer disease. Nat Rev Neurosci. 2019;20(3):148-160.
[27] Antila S, Karaman S, Nurmi H, et al. Development and plasticity of meningeal lymphatic vessels. J Exp Med. 2017;214(12):3645-3667.
[28] Taoka T, Masutani Y, Kawai H, et al. Evaluation of glymphatic system activity with the diffusion MR technique: diffusion tensor image analysis along the perivascular space (DTI-ALPS) in Alzheimer's disease cases. Jpn J Radiol. 2017;35(4):172-178.
[29] Wang L, Zhang Y, Zhao Y, et al. Deep cervical lymph node ligation aggravates AD-like pathology of APP/PS1 mice. Brain Pathol. 2019;29(2):176-192.
[30] Prinz M, Priller J, Sisodia SS, et al. Heterogeneity of CNS myeloid cells and their roles in neurodegeneration. Nat Neurosci. 2011;14(10):1227-1235.
[31] Fisher Y, Strominger I, Biton S, et al. Tp polarization of T cells injected into the cerebrospinal fluid induces brain immunosurveillance. J Immunol. 2014;192(1):92-102.
[32] Zhang J, Ke KF, Liu Z, et al. Tp7 cell-mediated neuroinflammation is involved in neurodegeneration of aβ1-42-induced Alzheimer's disease model rats. PLoS One. 2013;8(10):e75786.
[33] Dong Y, Yong VW. When encephalitogenic T cells collaborate with microglia in multiple sclerosis. Nat Rev Neurol. 2019;15(12):704-717.
[34] Sabatino JJ, Jr., Pröbstel AK, Zamvil SS. B cells in autoimmune and neurodegenerative central nervous system diseases. Nat Rev Neurosci. 2019;20(12):728-745.
[35] Ding XB, Wang XX, Xia DH, et al. Impaired meningeal lymphatic drainage in patients with idiopathic Parkinson's disease. Nat Med. 2021;27(3):411-418.
[36] Zou W, Pu T, Feng W, et al. Blocking meningeal lymphatic drainage aggravates Parkinson's disease-like pathology in mice overexpressing mutated α-synuclein. Transl Neurodegener. 2019;8:7.
[37] Schröder JB, Pawlowski M, Meyer Zu Hörste G, et al. Immune cell activation in the cerebrospinal fluid of patients with Parkinson's disease. Front Neurol. 2018;9:1081.
[38] Sulzer D, Alcalay RN, Garretti F, et al. T cells from patients with Parkinson's disease recognize α-synuclein peptides. Nature. 2017;546(7660):656-661.
[39] Orr CF, Rowe DB, Mizuno Y, et al. A possible role for humoral immunity in the pathogenesis of Parkinson's disease. Brain. 2005;128(Pt 11):2665-2674.
[40] Sweeney MD, Zlokovic BV. A lymphatic waste-disposal system implicated in Alzheimer's disease. Nature. 2018;560(7717):172-174.
[41] Sweeney MD, Sagare AP, Zlokovic BV. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nat Rev Neurol. 2018;14(3):133-150.
文章摘要: 在生理和病理条件下,脑膜淋巴管均能连接中枢神经系统与外周淋巴管。脑膜淋巴管不仅在脑代谢产物清除中发挥重要的作用,而且有助于抗原的递送和免疫细胞的激活。新型基因组技术的出现使得对骨髓和淋巴细胞的特征及其与中枢神经系统中脑膜淋巴管的相互作用的了解更为深入。此次综述概述了脑膜淋巴管在中枢神经系统免疫网络中的多方面作用,关注了脑膜淋巴管免疫生态位的最新发现,探索了中枢神经系统稳态和神经退行性疾病病理中脑膜淋巴管与免疫细胞之间的串扰作用,并讨论了这些相互作用如何影响病理结果。文章提出在衰老和神经退行性疾病中,脑膜淋巴管结构和功能的调控可能会影响淋巴引流、脑脊液中的免疫神经调节因子和免疫细胞群,从而在塑造脑膜和脑实质免疫中发挥关键作用的观点。
文章关键词: 中枢神经系统;脑膜淋巴管;免疫;髓细胞;淋巴细胞;神经退行性疾病
文章来源: Gao M, Wang X, Su S, Feng W, Lai Y, Huang K, Cao D, Wang Q (2025) Meningeal lymphatic vessel crosstalk with central nervous system immune cells in aging and neurodegenerative diseases. Neural Regen Res 20(3):763-778.











