引言
肠道是人体与外界环境直接接触的关键器官,时刻抵御着有害物质和病原体的侵袭。得益于其内在的干细胞系统,肠道具备了非凡的自我修复能力。尽管如此, 肠道干细胞 (intestinal stem cell, ISC ) 是如何感应到损伤信号,并从静息状态迅速激活,进而通过增殖和分化来修复受损肠上皮组织,目前科学界对此尚缺乏全面的理解。四川大学华西医院陈海洋团队的研究发现,在肠道受损时,肠道干细胞中的 过氧化物酶体 (Peroxisome) 数量显著上升,并通过调节JAK-STAT-SOX21信号通路,促进干细胞分化,对肠道的修复过程起到调控作用 【1】 。然而,ISCs中的过氧化物酶体如何响应肠上皮损伤信号,以及其数量如何在损伤修复过程中发生动态变化,这些机制仍有待进一步阐明。
2024年7月23日,四川大学华西医院 陈海洋 团队再次在 Developmental Cell 杂志上发表了题为 Very long-chain fatty acids control peroxisome dynamics via a feedback loop in intestinal stem cells during gut regeneration 的研究。该研究 揭示了肠道损伤后,肠道内的极长链脂肪酸 (Very long-chain fatty acids, VLCFAs ) 含量上升,并作为关键信号分子,通过激活过氧化物酶体增殖体激活受体 (peroxisome proliferator-activated receptors, PPARs ) 与SOX21转录因子之间的负反馈机制,精确调控ISC内过氧化物酶体的动态平衡。这一发现为理解ISC在肠道损伤后的修复机制提供了新的视角。

为了探究肠道损伤修复过程中过氧化物酶体在肠道干细胞中的动态变化机制,陈海洋团队利用小鼠和果蝇模型,观察到过氧化物酶体数量在肠损伤早期显著增加,并在修复后期逐渐恢复至基线水平。研究人员发现 游离脂肪酸 中的 极长链脂肪酸 ( VLCFAs ,碳链长度至少20个碳原子的脂肪酸) 动态变化与过氧化物酶体的变化趋势一致 (见图1) 。
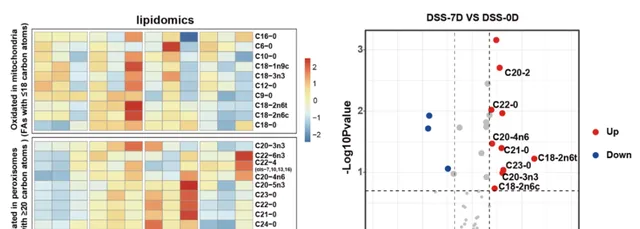
图1.损伤早期(DSS-7D)和修复早期(DSS-RE-5D)肠道中VLCFAs增多(Credit: Developmental Cell )
尽管VLCFAs在 细胞膜结构 和脂质代谢中的作用已被广泛研究,但其在动物体内的具体生理功能少有研究报道。该研究首次揭示VLCFAs可以作为信号分子激活细胞内调控转录因子的活性,并通过一条负反馈机制精确控制损伤修复过程中肠道干细胞中过氧化物酶体数量的动态变化。研究人员发现在肠道受损后VLCFAs通过调控PPARs和SOX21这两种转录调控因子在干细胞中的表达量使过氧化物酶体在分裂和自噬降解过程中达到一种巧妙的平衡,并向下传递信号影响ISC内部的 内膜系统 循环,从而调控ISC分化产生新的肠上皮细胞,并在修复完成后使ISC恢复至静息状态 (图2) 。
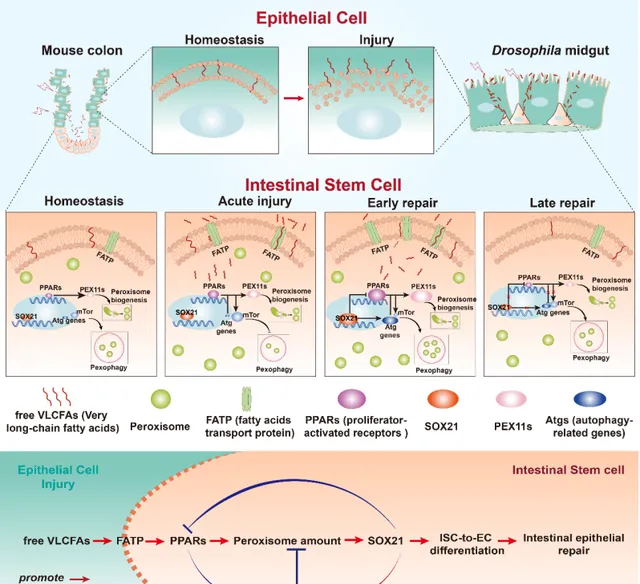
图2.模式图(Credit: Developmental Cell )
综上, 这项研究深入探讨了肠道损伤后调节干细胞内过氧化物酶体数量动态变化的详细机制,揭示了VLCFAs作为信号分子在此过程中的关键角色。 研究证实,通过调控过氧化物酶体的增殖,VLCFAs可以促进肠道损伤后的修复。这不仅丰富了我们对干细胞介导的肠道修复机制的理解,也有望为临床上治疗炎症性肠病 (IBDs) 等相关疾病提供新的治疗思路。
参考文献
1 Du, G. et al. Peroxisome Elevation Induces Stem Cell Differentiation and Intestinal Epithelial Repair. Dev Cell 53,169-184 e111, doi:10.1016/j.devcel.2020.03.002 (2020).
https://doi.org/10.1016/j.devcel.2024.06.020
责编 |探索君
排版|探索君
文章来源|「BioArt」
End
往期精选
围观
一文读透细胞死亡(Cell Death) | 24年Cell重磅综述(长文收藏版)
热文
Cell | 是什么决定了细胞的大小?
热文
Nature | 2024年值得关注的七项技术
热文
Nature | 自身免疫性疾病能被治愈吗?科学家们终于看到了希望
热文
CRISPR技术进化史 | 24年Cell综述











