2024年8月28日, 張鋒 團隊( 徐沛雨 和 Makoto Saito 為論文共同第一作者) 在 Cell 期刊發表了題為:Structural Insights into the Diversity and DNA Cleavage Mechanism of Fanzor 的研究論文【1】 。該研究展示了 Fanzor 蛋白在不同生物中所表現出的分子多樣性,並深入解析了其透過RNA引導的DNA切割機制,為進一步的基因工程改造和開發奠定了基礎。詳情:Cell:張鋒團隊揭示真核基因編輯系統Fanzor的結構多樣性和DNA切割機制
僅僅一天後, 張鋒 團隊在 Science 期刊發表重磅論文,該研究顛覆了教科書對遺傳資訊線性傳遞方式的定義,也顛覆了染色體擁有細胞用來產生蛋白質的一整套完整遺傳指令的觀點,揭示了「 隱藏基因 」的存在,表明從非編碼RNA的基因合成是原核生物中的一種 全新遺傳調控方式 。
1958年,DNA雙螺旋的發現者之一—— 法蘭西斯·克瑞克 (Francis Crick) 提出了著名的「 中心法則 」,為遺傳資訊的傳遞構建一個大框架: DNA→RNA→蛋白質 。根據這一法則,DNA作為基因樣版,轉錄生成RNA,RNA再轉譯為蛋白質。
1970年,科學家們在一些病毒中發現了 逆轉錄酶 ,這種酶可以將RNA逆轉錄成DNA,這為中心法則做出了重要補充,揭示了遺傳資訊並不只是單向流動,也可以實作從RNA→DNA的逆向流動。
自遺傳密碼被破譯以來,我們開啟了生命的天書,透過閱讀和解碼我們的染色體,我們得以辨識基因組中的基因,這種 線性的生命法則 被認為支配著所有的生命形式——從細菌到人類。教科書上對 蛋白質編碼基因 的定義是它沿著DNA軸線性編碼,以便基因的起始端始終位於基因末端的上遊。
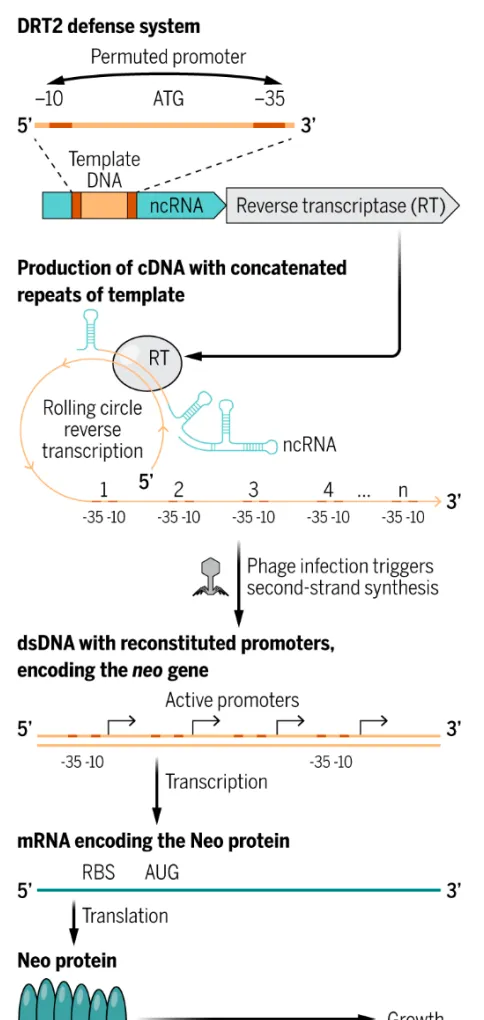
然而, 張鋒 團隊的這篇 Science 論文,與哥倫比亞大學 Samuel Sternberg 團隊稍早些發表的 Science 論文一起, 顛覆了教科書對蛋白質編碼基因的定義 ,揭示了 細菌中特有的抗噬菌體蛋白 ,這些蛋白並非直接由細菌的DNA編碼,為了產生這些蛋白,DNA首先被轉錄為非編碼RNA(ncRNA) ,然後透過 滾環逆轉錄 (rolling circle reverse transcription) 反應將其轉換為DNA(即從頭產生新基因) ,由此產生的DNA隨後被轉錄為編碼抗噬菌體蛋白的mRNA,mRNA再編碼為抗噬菌體蛋白,幫助細菌克服病毒(噬菌體) 的感染。


這兩項研究 強調了細菌逆轉錄酶以RNA為樣版創造新基因的基因組編碼潛力,是對中心法則這一遺傳資訊傳遞方式的挑戰,也將改變我們看待基因組DNA線性編碼遺傳資訊的傳統範式。
逆轉錄酶 (Reverse transcriptase,RT) 是一種利用RNA樣版來合成DNA的酶,廣泛分布於生命的所有領域。這些酶在多個過程中發揮作用,包括逆轉錄病毒和可移動遺傳元件的生命周期以及端粒生物學。
在細菌中,逆轉錄酶對於 抗噬菌體防禦 尤為重要,並被多種遺傳系統所利用,這些遺傳系統的作用是保護細菌免受噬菌體感染。例如,一些 CRISPR-Cas 系統就是利用逆轉錄來獲取對抗RNA噬菌體的新的核酸免疫盒 (spacers) 。逆轉錄酶也用於被稱為 反轉錄子 (Retron) 的抗噬菌體遺傳系統,該系統由三個基因組成,分別編碼一個逆轉錄酶、一個非編碼RNA和一個「效應」毒素。透過逆轉錄過程,反轉錄子產生一條DNA和RNA共價連線的嵌合核酸鏈。這種嵌合的DNA-RNA分子的作用尚不清楚,但已知它透過控制效應蛋白的毒性發揮抗噬菌體活性。此外,還有十多個其他細菌防禦系統編碼逆轉錄酶,但在大多數這些系統中逆轉錄的作用尚不清楚。
張鋒 團隊和 Samuel Sternberg 團隊各自獨立研究了 肺炎克雷伯菌 ( Klebsiella pneumoniae ) 中的一種包含逆轉錄酶的防禦系統—— 防禦相關逆轉錄酶2 (DRT2) 。
這兩項研究均發現,DRT2系統為細菌提供了強大的抗噬菌體防禦能力,並且在感染期間,編碼DRT2的細菌停止生長和分裂,不允許噬菌體復制。而DRT2系統僅編碼一個 逆轉錄酶 和一個 非編碼RNA (ncRNA) ,似乎沒有涉及任何其他蛋白質結構域或因子。
因此,這兩項研究都進一步探索了這種極簡系統究竟是如何既能辨識病毒 (噬菌體) 感染又能導致生長停滯的。他們發現,DRT2系統實際上編碼了另一種蛋白質,但該蛋白質的產生需要一系列復雜且意料之外的分子事件。
這兩項研究觀察到,逆轉錄酶 (RT) 使用相關非編碼RNA(ncRNA) 中一段特定的120個堿基作為樣版來生成互補DNA(cDNA) 。逆轉錄酶在一次逆轉錄過程中不會停止,而是跳回到120個堿基序列的起始點,並以所謂的「滾環」(rolling circle) 反應繼續進行,從而生成一個包含多個逆轉錄樣版重復序列的長cDNA。最常見的生成的cDNA包含樣版的五個串聯重復,有些cDNA甚至包含一百多個這樣的重復。
那麽, 這些cDNA可能起到什麽作用呢?
這兩項研究都指出,cDNA包含的序列基序幾乎與細菌σ70啟動子的共有序列相同。這些啟動子由兩個序列基序組成,即-35和-10基序 (之所以這樣稱呼,是因為它們分別位於轉錄起始位點上遊35個和約10個堿基處) 。DRT2系統ncRNA序列中的樣版重復包含這兩個基序,但排列方式不同,因此單個重復無法形成有效的啟動子;但當連線到cDNA上時,一個重復末端的-35基序與下一個重復開頭的-10基序處於正確的方向和距離,形成一個強大的啟動子,啟用了高轉錄率。
這兩項研究進一步確定,該啟動子驅動了mRNA轉錄,而這個mRNA反過來編碼了一種蛋白質,從串聯的cDNA轉錄的mRNA不包含任何終止密碼子,由於該蛋白質可能會非常長 (取決於cDNA中的重復次數) , 張鋒 團隊和 Samuel Sternberg 團隊都將其命名為 Neo ,意為「 永無止境的開放閱讀框 」( N ever- E nding O pen reading frame) ,這一命名也致敬了電影【黑客帝國】中的男主角救世主尼奧(Neo) 。
那麽, DRT2系統是如何幫助細菌對抗噬菌體感染的呢?
研究團隊發現,DRT2產生單鏈串聯的cDNA,但只有當細菌被噬菌體感染時,第二條鏈的合成才會啟動。一旦形成雙鏈cDNA,啟動子就會其驅動轉錄為mRNA,隨後mRN被轉譯成Neo蛋白,這種毒蛋白能夠迅速抑制細菌生長,從而阻止噬菌體復制和利用細胞資源。
編碼Neo蛋白所必需的遺傳資訊流非常不尋常。這種不常規的蛋白質編碼機制有什麽好處呢?
研究團隊提供了兩種可能的解釋。 一種解釋是 ,有毒基因的表達難以控制,其轉錄泄漏會導致不良後果,這被認為是編碼毒素的防禦系統在短的前進演化時間尺度內往往經常遺失的原因。在DRT2系統中,轉錄泄漏引起的自身免疫問題得到了解決,因為單個重復序列不包含啟動子並且本身無毒。 另一種解釋是 ,裂解性噬菌體在感染早期往往會降解宿主的基因組,部份原因是為了關閉細胞透過免疫蛋白的轉錄和轉譯來應對感染的能力。而DRT2系統巧妙地克服了這一挑戰,它依賴於一種在感染前已被轉錄的非編碼RNA (ncRNA) ,一旦噬菌體的DNA降解活性停止,就可以將這種ncRNA轉換回DNA。
目前尚不清楚DRT2系統如何感知噬菌體的存在,以及是什麽分子機制啟用了第二條cDNA鏈的合成。盡管 Samuel Sternberg 團隊的研究表明第二條鏈的合成是從與ncRNA末端共價連線的短DNA引物開始的,但這種引物是如何產生的還不清楚。
此外,還有一個值得關註的問題——Neo蛋白是如何抑制細菌生長的,Neo與任何已知的蛋白質都不相似,它抑制細菌生長的機制仍然是個謎。
來自細菌防禦系統的逆轉錄酶,特別是來自反轉錄子 (Retron) 的逆轉錄酶,因其能夠生成所選擇的cDNA而被用於基因組編輯。DRT2系統透過滾環逆轉錄生成雙鏈DNA的能力可能有助於生物技術套用,利用其擴增和連線樣版序列的能力。此外,細菌防禦系統還編碼了數十種逆轉錄酶,而它們的機制尚有待探索。
論文連結 :
1. https://www.cell.com/cell/fulltext/S0092-8674(24)00844-4
2. https://www.science.org/doi/10.1126/science.adq3977
3. https://www.science.org/doi/10.1126/science.adq0876











