膿毒癥休克中間質的作用:理解流體動力學的關鍵?
蘇州工業園區星海醫院 劉崗譯
重癥行者轉譯組

摘要
背景
間質,雖然並不屬於傳統的迴圈概念,但實際上在維持液體穩態中作用關鍵。調節液體平衡是膿毒癥休克的一個關鍵方面,眾所周知,液體平衡與預後有關。調節毛細血管內外液體流動是理解膿毒癥期間液體穩態的第一把鑰匙。
主要內容
膿毒癥休克期間,毛細血管通透性增加,過去普遍認為,毛細血管滲透性增加足以解釋為何炎癥期間毛細血管濾過增加。然而,血管內皮壁的另一側,間質可能在推動毛細血管泄漏方面作用更大。事實上,間質的細胞外基質形成了嵌入膠原骨架的復雜凝膠狀結構,且能透過降低間質細胞外基質的靜水壓直接將血管內液體吸引到間質中。因此,間質,不僅僅是一個長期以來認為的被動儲液池,而且可能是膿毒癥休克期間調節液體平衡的主要決定因素。然而,迄今為止,很大程度上忽視了間質在感染和膿毒癥休克中的作用。對間質的全面了解可能有助於理解膿毒癥休克的病理生理學。總體而言,我們已經確定了間質在膿毒癥休克病理生理學中的五大潛在作用:1.增加水腫,影響器官功能和代謝產物擴散;2.調節間質壓力,增加毛細血管內外液體流動;3.改變細胞外基質;4.分泌炎性介質;5.降低淋巴液流出。
結論 :我們旨在綜述文獻並總結當前這些特定領域的知識,以及研究間質相關的方法論知識。
關鍵詞: 間質,膿毒癥休克,微迴圈,毛細血管泄漏,細胞外基質
背景
間質通常定義為任何特定組織細胞間的真實間隙,但其本身也是一個有結構的組織。隨著活體內即時顯微觀察的進步,我們現在能夠描述大的具有厚厚的膠原束限制的充滿液體的多邊形解剖空間(圖1),特別是當這些空間位於皮下和消化道粘膜下層時。間質約占20%的體重,主要視為一個被毛細血管壁隔開的、與血管區相對應的液體區。過去迴圈的概念中,間質不屬於迴圈。然而,在心血管和淋巴系統間,透過維持整個身體內的連續液體迴圈,間質是維持內穩態(轉運代謝受質、廢物和免疫介質)的重要環節。血液和間質區間的持續流體轉運由所謂的Starling力控制。在膿毒癥和膿毒癥休克期間,Starling力急劇變化所致的強烈毛細血管滲漏,是導致膿毒癥休克早期低血容量的原因。彌漫性水腫,是膿毒癥休克後期的常見特征,也直接與毛細血管滲漏有關,但由於水腫臨床辨識延遲,掩蓋了這種關系。膿毒癥引起的水腫被液體治療加重,多數時稱為液體過負荷。近年來,已確定液體過負荷為膿毒癥休克患者致殘和致死的主要預後因素。

Mucosa粘膜、Collagen(膠原) bundles 膠原纖維束、CD34 positive(積極) lining cells CD34陽性的粘膜細胞、Fluid(流體) filled space(空間)充滿液體的空間
圖1:間質的三維結構,空間示意圖顯示一側排列著細胞的膠原纖維束網路,內部充滿液體。
由於間質擴張,短短幾天內,膿毒癥休克患者體重就可能增加三分之一,因此應重視這個「第三空間」,重癥醫生也應全面理解間質。長期以來,人們只關註了血管腔室,一直忽視間質,將其視為被動的儲備庫。過去幾十年裏,生理學的重大進展,揭示了間質在急性炎癥過程中(特別是在調節毛細血管過濾方面)發揮了重要作用。
總體而言,我們已經確定了間質在膿毒癥休克病理生理學中的五大潛在作用(圖2):1.增加水腫,影響器官功能和代謝產物擴散;2.調節間質壓力,增加毛細血管內外液體流動;3.改變細胞外基質;4.分泌炎性介質;5.降低淋巴液流出。
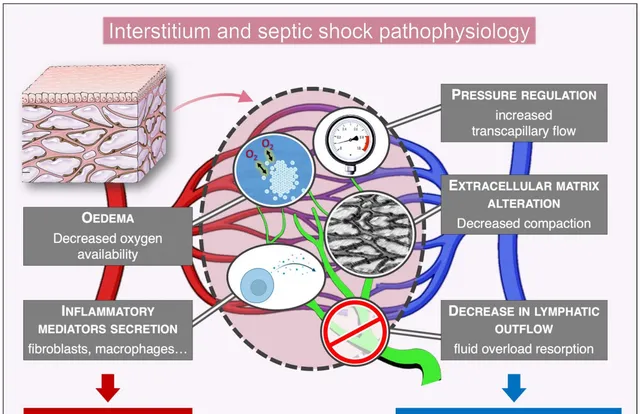
Interstitium(間質) and septic(化糞) shock(休克) pathophysiology間質與膿毒癥休克的病理生理學
PRESSURE(壓力) REGULATION(調節) increased transcapillary([網路] 經橈動脈) flow(流) 壓力調節 增加的毛細血管內外流動
EXTRACELLULAR MATRIX(矩陣) ALTERATION(蝕變) Decreased(減少) compaction胞外基質改變 緊密性下降
OEDEMA Decreased(減少) oxygen(氧) availability(可用性) 水腫 供氧減少
INFLAMMATORY(炎) MEDIATORS SECRETION(分泌) fibroblasts, macrophages炎癥介質分泌,成纖維細胞、巨噬細胞
DECREASE(減少) IN LYMPHATIC(淋巴) OUTFLOW fluid(流體) overload(過載) resorption淋巴流出減少,液體超負荷吸收
SHOCK(休克)休克
FLUID(流體) OVERLOAD(過載) 液體超負荷
圖2:膿毒癥病理生理學中可能的交互作用機制。毛細血管床周圍的間質區室示意圖(紅色:動脈側,藍色:靜脈側)。淋巴管顯示為綠色
為闡明間質在膿毒癥休克病理生理學中的潛在作用,我們旨在回顧文獻,總結文獻上的當前知識,以及與研究間質相關的方法論方面。
間質解剖學和組織學
間質通常定義為一種分隔血管和細胞的液體隔室。最近的研究表明,無論是組織還是器官邊界,間質空間都是連續的,微小物質可在結腸壁各層間或在皮下和筋膜間移動。所有器官都有間質組織,但其範圍在不同的「母體」組織間差異很大,其結構和組成也可能有所不同,但外周血管周圍間質與皮膚和腺體基底膜周圍的松散結締組織相似。盡管早就知曉間質的組成,但直到最近才觀察到其三維結構(圖1),這主要是由於體內顯微鏡技術的進步。通常,細胞外基質(ECM)由三維纖維膠原網支撐,其中膠原纖維形成厚厚的、寬20微米的束。微纖維-彈性蛋白框架也附著在膠原束上,將應力均勻地分布到間質結構中。基質由蛋白聚糖形成,不僅包括與核心蛋白共價連線的糖胺聚糖(GAGs),還包括遊離的GAG(即透明質酸)。GAGs是由多個二糖單位組成的長鏈線性結構,極性很高並吸引水分,從而形成凝膠狀結構。GAGs與ECM的膠原結構交互作用,但間質液中也有遊離的GAGs。間質液本身是血漿的超濾物,其蛋白質濃度約為血漿的50%。間充質細胞覆蓋在ECM外面並提供支持。
水腫:急性間質性水腫的發生和後果
局限性炎癥時,為快速募集控制病原體所需的體液(例如,抗體,補體)和細胞(嗜中性球,單核球)成分,局部的血液流動和通透性增加。膿毒癥期間,全面過度啟用先天免疫導致彌漫性內皮改變,引起大、小迴圈功能障礙。在毛細血管水平,內皮屏障改變可能是膿毒癥最重要的後果,導致每層內皮壁都受損,從而使得毛細血管滲漏。VE-鈣粘蛋白是內皮細胞間連線的主要組成部份。而由炎癥細胞因子(TNF-α,IL-1β,IL-6和IL-10)引發的VE-鈣粘蛋白內化(譯者註:內化通常指的是細胞吸收或攝取某些物質(如蛋白質或更大的分子)的過程。在這裏內化可能指的是VE-鈣粘蛋白在炎癥細胞因子的刺激下被細胞吸收的過程),足以破壞細胞間連線,從而增強血管通透性,這也受到其他因素的影響,如糖萼的改變。血管通透性增強經常認為是膿毒癥休克期間驅動和維持毛細血管滲漏的必要充分條件。然而,應該記住,其他「力量」也正在起作用,並驅動與膿毒癥相關的液體過載。
Starling定律
毛細血管濾過從而形成水腫的病理生理學,最初由Ernest Henry Starling在1896年描述。作為各種因子的函式,跨毛細血管過濾可用以下公式中表達:
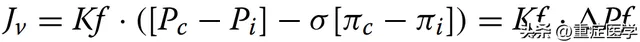
在這裏
Jv是每秒經內皮濾過的體積,Kf是膜的過濾系數,Pc是毛細血管靜水壓,Pi是間質靜水壓,πc是毛細血管膠體滲透壓(COP(警察)),πi是間質膠體滲透壓,σ是血漿蛋白的反射系數,ΔPf是凈過濾壓力。
毛細血管的靜水壓(Pc)從小動脈端的30-40 mmHg逐漸下降到靜脈端的10-15 mmHg。血漿和間質滲透壓分別約為28 mmHg和8 mmHg。正常的間質壓力略負,在-1到-3 mmHg間。經典的Starling定律觀點預測,由於毛細血管靜脈端Pc和πi的下降,從間質吸收到血管腔上問液體吸收應發生在毛細血管的靜脈端,這就一定程度上補償了血管腔中濾出的體積。根據大量先前的實驗數據,2010年Levick和Michel修訂了這一經典觀點,得出了「濾過是動態」的規則。事實上,他們表明,經典的斯特林公式中,πi可由糖萼下方COP(πg)替代,這是因為內皮屏障中蛋白質的反射元素實際上是糖萼纖維基質,其作用類似於超濾篩。由於細胞間隙中的高流速,間質蛋白無法透過糖萼下空間擴散回流,πg恒定低於πi(約為10%),而經典觀點認為間質壓力可忽略不計。這解釋了穩態下毛細血管靜脈端,盡管Pc降到πc以下,但仍未觀察到濾過。然而,瞬時吸收仍可能發生,例如出血時,這是由於Pc急劇下降和πc增加。吸收也自然發生在腸粘膜和腎小管周圍間質中。
水腫預防因子
因此,修訂後的Starling定律指出,淋巴引流在穩態下等於毛細血管過濾。然後,水腫的形成是由於毛細血管過濾增加和/或淋巴流出降低之間的失衡。生理學中,保護機體免受水腫的機制已有廣泛描述,特別是Guyton在這方面做出了非常重要和顯著的工作。首先,增加的毛細血管濾過增加了間質容積,又透過稀釋降低了間質滲透壓,從而反過來減少了濾過。防止水腫形成的另一個保護因素是間質順應性,這定義為在間質容積(ΔVi)增加一定量時,變化的間質壓力(ΔPif),每種組織的間質順應性都不一樣。在脫水的基線狀態和液體過度的初始階段,容積-壓力曲線是線性的,這保護了組織免受水腫(圖3,實線)。當極度液體過度時,順應性可能是無窮大的,並且在皮膚和肌肉間質中觀察到容積-壓力曲線的平台。皮下間質組織順應性特別大,可積累大量的水腫。液體過載時,皮下間質占總容積的確切大小難以評估,但可能超過50%,因為穩態時,皮膚和肌肉已占據了總細胞外容積的三分之二。
圖3:穩態和炎癥時的間質壓力-容積曲線。正常狀態下,間質容積-壓力曲線的一般形狀用實線(A)表示,實線含間質容積(Vi)和壓力(Pif)的正常值。在脫水和過度水化的初始部份,順應性(∆Vi /∆Pif)恒定。在獲得Pif的最大升高(∆Pif max)後(反映了對過濾的最大對抗性壓力),順應性增加到無窮大(P/V曲線中的平台)。間質液體容積過度增延長,順應性再次下降。炎癥時,該曲線向紅色虛線變化。如果過濾受阻,例如毛細血管血流中斷,就會阻止間質容積增加,Pif會突然下降(B)。如果維持毛細血管流動,過濾率可能增加10-20倍,間質Vi可快速擴張,而間質壓力變化很小(C)。
液體超負荷,膿毒癥休克期間毛細血管滲漏的表現,同時也是預後因素
膿毒癥休克的初期管理中,通常需要大量的復蘇液體來補償毛細血管的泄漏。水腫在所有組織(尤其是皮下組織)中積累,積累程度也反映了毛細血管泄漏的強度。近年來,已確定水腫(即,液體過負荷)為膿毒癥休克患者的致殘和致死的主要預後因素。然而,液體過負荷與不良預後間的關系性質尚未完全理解。首先,可以認為,急性期毛細血管泄漏強度與休克的嚴重程度直接相關。然而,另一方面,大多數發現這種關聯的研究中,死亡率都根據初始休克嚴重程度做了調整(譯者註:即在考慮了休克的初始嚴重程度後,毛細血管泄漏強度仍與死亡率相關)。此外,對膿毒癥休克患者的觀察性研究確定,液體負平衡的患者預後更好,這表明間質水腫本身可能會造成傷害。間質水腫增加了細胞間隙,長期以來一直認為細胞間隙是組織氧合的關鍵因素。實際上,氧分子(O2)是一種「疏水性」的、非極性分子,其在水中的溶解度和擴散性低,這使得其難以透過如間質液和細胞質等水性介質擴散。人們認為,氧經網狀的脂質「疏水性通道」彌散,特別是在細胞內彌散時。因此,間質水腫與增加的彌散距離確實可能是膿毒癥相關的氧攝取下降和代謝障礙的突出因素。間質水腫對預後效應的另一證明可在水腫對器官功能障礙的直接影響中找到,如水腫對急性呼吸窘迫症候群(ARDS)和急性腎損傷的直接影響。某些學者還描述了液體過負荷是腹腔間隔症候群的風險因素。
鑒於這些數據,減少液體過負荷已成為主要的治療目標。目前,限制液體是旨在減少液體過負荷的主要可選治療策略。2015年至2020年間發表的薈萃分析並未發現任何顯著的益處,無論是全因死亡率還是如急性腎損傷或肺損傷等次要預後結果。2022年,Meyhoff等人報告了 classIC研究的結果,該研究也未發現限制性和自由性液體策略間的死亡率(或任何次要預後)有任何差異。2023年發表的CLOVERS試驗證實了這些發現,沒有死亡率差異,且限制輸液組的升壓藥物使用增加,增加了不良事件但未達到統計學差異。總的來說,對液體平衡幹預的效應較小,並不總具有統計學意義。這些試驗的陰性結果強調了這個問題是復雜的,並暗示限制液體的方法可能不合適。
間質液評估:間質容量
水腫開始形成的時間非常早,但只在膿毒癥休克後的24-48小時才明顯,因為間質液約4升以下時,臨床上無法檢測到水腫。實際上,對膿毒癥休克中液體超負荷的臨床評估不足,缺乏敏感性。每日液體平衡監測是測量液體超負荷程度的最簡單、最直接的方法。在過去一個膿毒癥休克患者佇列研究中,Boyd報告了到第4天的累積平均液體正平衡為+11升,更正的液體平衡與這些患者的死亡風險增加相關。為最準確測量血液腔室容積和跨毛細血管濾過率,需要註射一劑放射性碘標記的白蛋白,這樣就能測量跨毛細血管逃逸率(TER)。該技術旨在評估膿毒癥期間白蛋白輸註的益處,但未能證明白蛋白輸註能降低血管通透性。在一個使用同位素測量血容量和TER分析的重癥患者(大多數為膿毒癥休克)的隨機研究中,44%的病例透過分析改變了液體管理,幹預組的總體死亡率顯著降低。這突顯了評估重癥患者液體狀態的困難。透過晶體液輸註引起的血液稀釋,使用「容量動力學」方法,巧妙地探索了血管內和間質容積間的差異。該方法能預測健康誌願者和麻醉患者的血漿和間質中的液體分布,並且還證實了Guyton預測的「間質白蛋白洗脫」現象(譯者註:「間質白蛋白沖洗」現象是指間質中的白蛋白被轉移到血漿中。這可能是透過加速淋巴流動或透過某種其他機制募集白蛋白實作的。該現象最初是由著名的生理學家Arthur Guyton提出的,用來對抗毛細血管過濾增延長的周圍水腫。該現象表明,盡管液體過載可能會導致間質水腫,但是,透過這種「間質白蛋白沖洗」機制,白蛋白和液體可以從間質空間返回到血管,從而幫助維持血管內的容積,然而這種機制在幾個小時後可能會耗盡)。
炎癥時的間質壓(和跨毛細血管血流)調節
測量間質壓
Arthur C. Guyton是測量間質壓的先鋒,他在動物模型中透過植入穿孔膠囊開發了測量間質壓的標準技術。在幾周時間穿孔愈合和穩定後,就可測量壓力。1980年代,有了許多測量間質壓力的新方法。然後在動物模型中開發了各種皮下導管技術,使用充滿液體的側精靈管或滲透性織物(wick)的註射針技術(譯者註:這個技術的基本原理是將帶有織物的針插入組織間隙,使織物與周圍的間質液體接觸。由於織物是滲透性的,液體可以透過織物滲透到內部。透過測量滲透到織物中的液體的壓力,可以推斷組織間隙的壓力情況)。此後,大多數實驗研究都使用了與自動反壓系統連線的玻璃微管。最後,壓力傳感器的微型化使得能開發出可靠且準確的用於測量壓力的導管,盡管它們的尺寸仍顯著大於微管。
燒傷模型中發現的間質壓力調節
如果升高Pif(間質壓力)可防止水腫,那麽降低Pif就足以增強毛細血管的過濾並促進水腫。健康誌願者中,對下肢施加負壓會導致腿部間質壓力幾乎瞬間下降,液體濾過增加,腿部出現水腫。炎癥期間,迅速形成的水腫不僅因內皮屏障破壞,還因間質壓力的突然下降。實際上,燒傷時,明顯的水腫會在幾分鐘內出現。間質容積必須至少增加一倍,水腫才會明顯。因為間質液通常在12到24小時內更新一次,因此過濾率必須在短時間內增加數百倍以上,才能產生水腫。研究測量了實驗性燒傷損傷期間Kf(毛細血管滲透系數)的變化,發現Kf增加了2到3倍。透過這種中度的Kf增加,計算出凈過濾壓力必須增加到200mmHg,才能解釋觀察到的過濾率。為驗證該假設,Lund等人在大鼠的熱燒傷實驗模型中測量了間質壓力。他們觀察到,熱傷後,皮內Pif從正常水平的-1mmHg降低到高度負值(-150mmHg)。因此,確認了凈過濾壓力增加的假設,主要是由於Pif的降低,而不是Pc(毛細血管壓力)的增加。這項具有裏程碑意義的研究,其結果隨後被其他團隊在類似的模型中證實,它首次證明了間質組織透過「吸引」在水腫中發揮了積極作用。
對其他局部和全身性炎癥模型的拓展
「間質吸引」現象已在全身性炎癥模型中得以再現,例如在透過靜脈註射右旋糖酐引起的大鼠過敏反應中,皮下間質組織中的Pif降低了10 mmHg。同樣,「膿毒性」炎癥似乎也有相同效應。在實驗性大鼠模型中,註射LPS降低了間質壓力,並促使水腫形成和I-125標記的白蛋白滲出。在之前狗的內毒質性休克模型中,觀察到類似的降低,間質壓力立即降低了高達9 mmHg。
除了炎癥,這種間質「吸引」現象的力量也在唾液腺中得到了展示,它使得蔬菜刺激後能產生唾液的爆發分泌,這時跨毛細血管流量增加十倍。這個生動的例證,說明「間質吸引」在日常生理功能中,有能力在有限的時間內從迴圈中募集大量液體。
有趣的是,研究發現腎上腺素的血管收縮和升壓效應也會降低間質液壓(Pif)。在他們的研究中,Border等學者探索了不同型別的休克和單獨套用血管加壓藥對使用Guyton技術測量的間質液壓的影響。如前所述,內毒素休克的特征是Pif的顯著但短暫的降低(由於毛細血管濾過增加導致Vi增加,這解釋了為何會恢復到休克前的Pif值)。然而,在出血性休克和單獨套用兒茶酚胺的情況下,Pif也降低了,但降低是恒定的且與兒茶酚胺劑量相關。據作者的預測,這是由於血管加壓藥物減少了血管體積(從而相對增加Vi),這符合Starling原理。這些結果也可以透過由於極端血管收縮導致的毛細血管流量減少來解釋。
細胞外基質和成纖維細胞的作用
因此,透過促進體液和細胞介質的轉運,水腫並非偶然,而是代表了一種精細調節的機制,是局部免疫反應的必要組成。的確,如上所述,「間質吸引」現象會促進炎癥性水腫。調節間質壓力主要基於成纖維細胞和細胞外基質(ECM)間的交互作用。
成纖維細胞不僅與細胞外基質(ECM)交互作用,還在這個分子網路中調節間質壓力。透過表達特定的整合素,尤其是透過其ß1亞基(例如,整合素α2ß1),成纖維細胞能結合到膠原纖維。整合素是包括2個亞基的跨膜蛋白,能雙向粘附,能將細胞骨架粘附到ECM上。因此,透過與膠原的交互作用,ß1整合素亞基使持續的機械張力傳遞到細胞外基質,抵消在水化作用下糖胺聚糖(GAGs)自然擴張的趨勢。因此,當對膠原纖維施加的壓力快速釋放時,可能會引起壓力的突然下降(見圖4)。

圖4:微迴圈與間質細胞外基質在穩態(左圖)和膿毒癥期間(右圖)的交互作用。穩態下,跨毛細血管流動受堅固的內皮屏障和穩定、輕微負壓又緊密排列的間質調控(左圖)。成纖維細胞對網狀的膠原束施加恒定的張力。透過跨膜蛋白ß1整合素,成纖維細胞的細胞骨架與膠原IV相連。而炎癥時(右圖),炎癥介質(尤其是IL-1ß)抑制了ß1整合素與膠原束結合,釋放了束縛膠原網路的物理張力,導致間質壓急劇降低。此外,各種由先天免疫細胞釋放的蛋白酶不僅會改變糖萼,也會類似地改變細胞外基質。由於濾過壓(毛細血管壓力-間質壓力)增加和細胞間粘附抑制和糖萼脫落導致的內皮通透性同時增加,使得跨毛細血管流動大量增加。。
體外實驗中,透過評估成纖維細胞介導的懸浮膠原I型凝膠的收縮,證明了ß1整合素亞基在水腫形成中的作用。在該研究中,顯示了成纖維細胞能夠在24小時的培養期內將膠原凝膠收縮至初始凝膠體積的10%。這些發現得到了體內實驗的驗證,其中在大鼠皮膚中阻斷ß1整合素粘附受體導致降低了間質壓和水腫。炎癥時,諸如IL-1β和TNF-α等促炎介質,透過作用於ß1整合素亞基,對抗該收縮,降低了間質壓,進而形成水腫。血小板源性生長因子(PDGF)對與β1整合素相關的這種級聯反應產生反向效應,透過收縮成纖維細胞和介導另一種整合素亞基(αVβ3)來增加間質壓力。腫瘤中,間質擴大且間質壓增加,PDGF抑制劑逆轉了腫瘤誘導的間質壓增加,並透過促進毛細血管過濾和抗腫瘤藥物的局部擴散來改善抗腫瘤反應。
此外,細胞外基質(ECM)的糖胺聚糖(GAGs)也參與了間質容積的調節。GAGs帶負電荷,特別能與細胞外液中最豐富的陽離子鈉交互作用。根據GAGs的空間構象,其積累的鈉不同,導致形成的間質體積也不同,有的地方會形成水腫和有的地方水腫會消退。膿毒癥期間,由於醛固酮增多癥,鈉負荷增加,這一現象因ECM對鈉的「結合力增強」而得到加強,總體上這可能阻礙水腫的消退,並幹擾間質鈉、巨噬細胞滲透感受器和VEGF誘導的淋巴管新生的復雜交互作用。
細胞外基質改變
細胞外基質(ECM)構建了間質空間的物理結構。炎癥性功能性變化,導致了ECM不再緊密。此外,炎癥還會直接改變ECM的結構性成分,這是由浸潤的嗜中性球被IL-1β和TNF-α啟用後釋放的強效催化酶引起的,如基質金屬蛋白酶(MMPs)、肝素酶和透明質酸酶。膿毒癥時,還發現了大量ECM的降解證據,從而提出了「全身性創傷」的概念。相對於對照組,在診斷膿毒性休克患者時,迴圈中交聯的I型膠原肽段(ICTP,I型膠原降解的標誌物)的水平要高五倍。這項研究中,膠原合成的標誌物也增加了,盡管只有膠原III的前體(而非膠原I的前體)增加。相對於存活者,未存活患者的ICTP和膠原前體的水平也高。革蘭氏陰性膿毒癥的患者中,也發現ICTP水平升高,其他膿毒癥患者的膠原III前體水平也增加。ARDS期間,膠原III前體也增加,並可能是纖維化進展的重要促進因素。
Koskela及其合作者們的一項小型描述性研究報告稱,重癥膿毒癥早期,表皮層對粘連蛋白-332和IV型膠原蛋白的表達都下降,且在幸存者中持續了3個月。Hoffmann和他的合作者們報告稱,重癥膿毒癥中基質金屬蛋白酶及其抑制劑(MMP-9,TIMP-2和TIMP-1)濃度升高,而認為TIMP-1是預測重癥膿毒癥患者臨床預後的有用生物標誌物。另一項研究證實了TIMP1和MMP9在膿毒癥期間的預後作用。
膿毒癥時,細胞外基質(ECM)改變的後果目前尚不清楚。ECM改變可能會增加毛細血管過濾,因為ECM的物理結構對調節間質壓力至關重要:膠原和蛋白聚糖的改變可能會破壞ECM的緊密結構。這得到了實驗數據的支持:酶解反應增強了離體浸泡在等滲鹽水中的松散結締組織的腫脹,而正常情況下膠原纖維網路能限制這種腫脹。此外,提出維生素C對膠原的保護是其在燒傷模型中預防水腫效應的潛在機制。此外,ECM的改變在水腫的吸收過程中,即膿毒性休克液體管理的降級階段,可能尤為重要。首先,與完整的ECM相比,改變的ECM可能喪失增加間質壓力和啟動淋巴引流壓力梯度的能力。其次,間質中膠原的減少增加了間質蛋白含量,這是由Wiig等人描述的膠原纖維的「空間排斥」現象所致。事實上,對正常ECM而言,白蛋白和其他大分子的表觀分布容積低於總的間質容積,因為由膠原網路限定的多個空間並不完全適合白蛋白和其他大分子分布。增加的間質蛋白品質可增加膠體滲透壓,並直接損害液體轉移,因為需要更高的淋巴流量(「洗脫」)來恢復間質液體體積。盡管臨床數據尚缺乏,但恢復ECM結構可能是膿毒癥休克患者實作液體負平衡的先決條件。
細胞外基質修復和適應
間質流動增加對ECM和駐留細胞有生物物理效應。機械應力及炎癥可誘導成纖維細胞分化為肌纖維細胞,最終可能導致纖維化。研究發現,間質流動增加可透過上調MMP-1(基質金屬蛋白酶-1)來誘導成纖維細胞運動,並透過TGF-ß依賴的機制驅動肌纖維細胞的分化和基質有序排列。在間質流動增加開始後的12-24小時內觀察到ECM有序排列,而肌纖維細胞的分化則需要1-5天。值得註意的是,ECM的纖維垂直於間質流進行重新排列,降低了基質的傳導性。這種重新排列的另一個值得註意的效應是剪下應力從細胞轉移到基質纖維上。基質重新排列和成纖維細胞收縮也增加了ECM的硬化。總體而言,這些體外研究結果表明,持續增加的間質流可迅速導致ECM的硬化、重新排列和肌纖維細胞的分化,這些都是間質纖維化的標誌。
目前尚不清楚是否會在持續炎癥的重癥患者中形成間質性纖維化,但這可能會導致愈合不良,並出現持續的液體超負荷狀態,常見於更嚴重的患者中。
間質源性炎癥(局部介質產生)
間質液評估:收集和分析間質液
鑒於間質的新興作用,似乎有望從間質液中發現新的生物標誌物。然而,獲取間質液頗為困難。20世紀,為引流心力衰竭患者的水腫,曾皮下植入金屬管(「Southey's tubes」)。目前已放棄這種有創性技術,但在ICU我們仍可觀察到,明顯水腫的患者中,皮下間質液很容易經皮膚裂口流出。在淋巴液流入淋巴結前行淋巴導管置管技術可能是獲取「純凈」間質液的最佳途徑,但有創,需要微創手術技能。微透析技術是為了確定間質組織的生化成分而開發的。目前主要用於監測重癥腦損傷患者的缺血相關代謝變化。由於半透膜,微透析技術僅限於對離子和小代謝物的分析。而微灌註技術無需交換膜,因此能分析更廣泛的分子,如細胞因子。在藥理學研究中,尤其是局部使用的藥物研究中,微灌註技術得到了廣泛套用。
膿毒癥和其他炎癥性疾病中的間質探索
用於生物標誌物分析的間質液比血液更難以獲取,然而許多炎癥標誌物是局部產生的(,因此,如能夠成功獲取和分析間質液,可能會發現一些血液中無法檢測到的重要生物標誌物)。Olszewski等在類風濕性關節炎患者和對照受試者中進行了下肢淋巴管置管,並連續收集了72小時的流入淋巴結節前的淋巴液。對於測量的大多數促炎細胞因子(IL-1 β,TNF-α,IL-6,IL-8),發現淋巴液/血清濃度比大於1,就表明是局部產生。這些細胞因子也主要參與膿毒癥的病理生理過程,並且大部份由巨噬細胞產生。此外,細胞因子濃度的個體間變異,或者由甲潑尼龍治療引起的變異,能清晰地反應在淋巴液濃度上,而血清濃度並未顯著變化。
Ikeoka等在九名重癥膿毒癥患者腹部皮下脂肪組織置入微灌註導管,發現IL-1β、IL-6和IL-8的濃度在皮下脂肪組織中高於血清,表明這些促炎介質由遠離感染部位的皮下間質產生。此外,血壓與IL-1β、IL-6和IL-8的皮下濃度負相關。內毒素血癥大鼠模型中,使用皮膚離心法已證明了皮下間質產生IL-1,這表明在全身性炎癥刺激期間皮下間質參與其中。免疫組織化學研究顯示,產生這些細胞因子的細胞主要是間質成纖維細胞,還有表皮細胞和毛囊。在炎癥性水腫形成中,這些學者還展示了IL-1β和TNF-α有濃度依賴性的直接機械作用,並報告了將內毒素血癥中類似濃度的細胞因子套用於皮下組織後,間質壓立即下降。在心臟手術患者的皮下脂肪組織中,也證明了遠處間質產生細胞因子,間質液中IL-6增加,其源自具有核因子-κB調控基因啟用的脂肪細胞。間質產生的細胞因子也可能也起源於Benias等學者在上皮下間質顯微研究中觀察到的一群有CD34+(一種通用的髓系細胞標記物,也存在於某些間質細胞表面)的間質成纖維細胞,實際上,當體外用腫瘤壞死因子(TNF)刺激時,有CD34的成纖維細胞分泌大量的IL-6、CXCL12和CCL2,這表明炎癥期間它們有募集單核球的作用。
改變淋巴液流出
淋巴系統在迴圈中作用關鍵。穩態下,流入淋巴結前的淋巴液流量等於毛細血管過濾量,估計每天透過始於末端封閉的間質淋巴系統重吸收8-12升淋巴液。內皮細胞間的連線就像間質液的單向閥,引導間質液流入淋巴節前的收集系統。淋巴管壁中包裹的平滑肌細胞的節律性收縮以及單向閥,維持淋巴系統內的壓力低於周圍的大氣壓。與血管一樣,淋巴管也對炎癥介質做出反應。因此,經典的擴血管介質(如一氧化氮、前列腺素、組織胺)與促炎細胞因子會下調淋巴管收縮。淋巴引流對抗原和樹狀細胞轉運到淋巴結非常重要。這解釋了為什麽局部炎癥期間能觀察到強烈的CD11+巨噬細胞誘導的淋巴管生成,淋巴管的生成彌補了淋巴管收縮能力的降低並使得區域淋巴流量增加。而在全身性炎癥的急性狀態下,如膿毒癥,淋巴管的生成可能不足以克服炎癥引起的淋巴松弛的全身效應。因此,炎癥引起的淋巴引流減少可能是膿毒癥期間液體失衡的主要因素,並被一些作者視為治療靶點。
此外,淋巴系統的改變在器官損傷的開發中也起著關鍵作用,並可能阻礙愈合機制。在肺部,淋巴迴圈的作用在肺移植中得到證實,肺移植時中斷了淋巴管。肺移植受者表現出持續性水腫,然而,對淋巴管和淋巴管新生在原發性移植物功能障礙中能起多大作用,目前尚存爭議。肺水腫的吸收對ARDS預後至關重要。透過跨膜泵,肺泡腔的液體轉運到間質。在LPS誘導的急性肺損傷中,淋巴管新生標記物增加與改善液體清除和生存相關。淋巴在急性器官功能衰竭中的作用在急性腎損傷(AKI)的小鼠模型中得到證實,其中淋巴擴張改善了恢復,暗示淋巴管生成在防止AKI進展為慢性腎臟疾病中的重要作用。盡管在人類膿毒癥中缺乏臨床數據,但淋巴引流的作用在膿毒癥的消退階段顯然非常重要,無論對器官功能障礙恢復還是常見液體過負荷的吸收都至關重要。
結論
間質並未被動旁觀,而是在調節跨毛細血管液體流動中最終嶄露頭角,特別是其在抽取血管內液體的能力方面。在局部炎癥和腫瘤環境中,間質對毛細血管過濾調控中的重要作用證據越來越多,但膿毒癥時,間質的參與證據仍稀缺。膿毒癥時,關於其確切作用仍然存問題多多:壓力變化的振幅是多少?是否有器官特異性反應?皮下成纖維細胞和脂肪細胞在細胞因子分泌中的各自作用是什麽?細胞外基質(ECM)損傷在水腫的形成和消退中的作用是什麽?在當前個人化的醫療時代,研究這個鮮為人知的領域可能會帶來有價值的見解,增強我們對病理生理學的理解,並為探索新的生物標誌物和治療方法開辟獨特的視角。











