編譯:微科盟 雨,編輯:微科盟 景行、江舜堯。
微科盟原創微文,歡迎轉發轉載,轉載請註明來源於【轉錄組】公眾號。
導讀
花青素是一類重要的次生代謝產物,決定了菊花(一種著名的切花)五顏六色的花瓣。「Arctic Queen」是一種白菊花品種,在開花階段不會積累花青素。在開花後階段,「Arctic Queen」的花瓣會積聚花青素並變成紅色。然而,這種花色變化背後的分子機制仍不清楚。 本研究透過轉錄組分析,鑒定出 CmNAC25 是促進「Arctic Queen」開花後階段花青素積累的候選基因。CmNAC25直接與 CmMYB6 的啟動子結合,CmMYB6是促進菊花青素生物合成的MBW蛋白復合物的核心成員,以啟用其表達。CmNAC25還直接啟用 CmDFR 的啟動子, CmDFR 編碼花青素生物合成中的關鍵酶 。 CmNAC25 在開花後階段高表達,而 CmMYB#7 (一種已知的R3 MYB轉錄因子)的表達水平顯著降低,該轉錄因子幹擾了CmMYB6-CmbHLp復合物的形成。菊花和煙草( Nicotiana tabacum )的遺傳轉化證實,CmNAC25是花青素生物合成的正調節因子。另外兩個在開花後階段變紅的品種也表現出類似的機制。 綜上所述,CmNAC25透過直接啟用 CmMYB6 和 CmDFR ,在開花後階段正向調控菊花花瓣中花青素的生物合成。 本研究結果揭示了CmNAC25在調控花瓣衰老過程中花色變化的關鍵作用,為菊花花色的分子設計育種提供了靶基因。
論文ID
原名: CmNAC25 targets CmMYB6 to positively regulate anthocyanin biosynthesis during the post-flowering stage in chrysanthemum
譯名: CmNAC25靶向 CmMYB6 正向調控菊花開花後階段花青素的生物合成
期刊: BMC Biology
IF: 5.4
發表時間: 2023年10月
通訊作者: 陳發棣
通訊作者單位: 南京農業大學
DOI號: 10.1186/s12915-023-01719-7
實驗設計
結果
1 菊花「Arctic Queen」的花色在花後階段由於花瓣中花青素的積累而變紅
本研究使用了切花品種「Arctic Queen」 (圖1)。 為了分析菊花花瓣在開花後階段的顏色變化,研究者將花序完全開放後的開花過程分為S1(全花期)、S2(盛花後10 d)和S3(盛花後20 d)3個階段(圖1A) 。如圖1A所示,最外層射線小花的花瓣顏色在S1處為白色,在S2處變為淺紅色,在S3處變為更紅。花瓣顏色的CIE L*a*b* 分析顯示,花瓣的 a* (紅度)和 C* (色度)值逐漸增加,而 L* (亮度)和 b* (黃藍色)值從S1到S3逐漸降低(圖1B)。 色素定量分析表明,S1處花瓣未檢測到花青素,S2-S3花瓣中花青素含量增加 ,與表型一致(圖1C、D)。 這些結果表明,由於花青素的積累,「Arctic Queen」花瓣的品種在開花後階段逐漸變紅 。
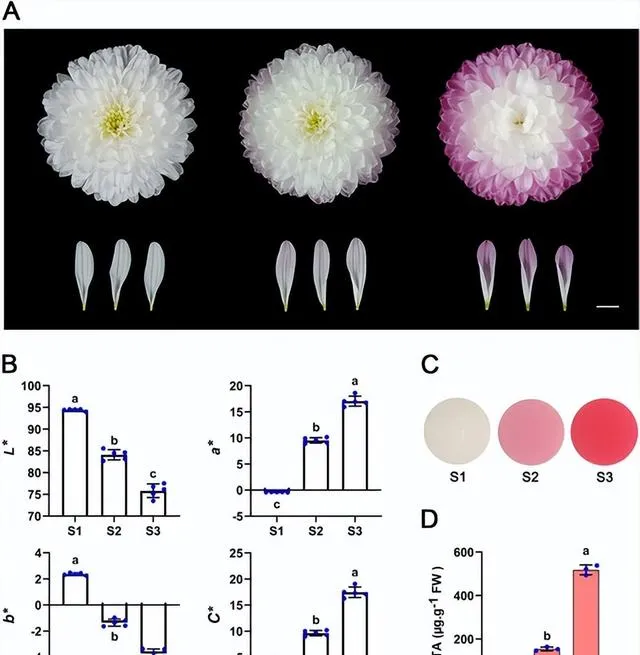
圖1.菊花「Arctic Queen」花瓣中的花青素積累在開花後階段誘導花色。 比例尺= 1cm。 A 花後階段花色的變化。S1(白色),S2(略帶紅色),S3(明顯紅色)。 B CIE L*a*b* 花瓣在3個開花期的顏色參數。誤差線表示五個生物學重復的SD。 C 從三個花期的花瓣中提取花青素。 D 3個花期花瓣中總花青素含量(TA)。誤差線表示三個生物學重復的 SD。B和D中的不同小寫字母表示差異顯著( p <0.05,變方分析,Tukey校正)。
2 菊花花瓣3個花期的轉錄組學分析
研究者從S1、S2和S3階段采樣的「Arctic Queen」最外層射線小花中提取的總RNA進行為RNA-Seq分析。共獲得9個樣品(三個階段中每個階段進行3次生物學重復)。組裝過程的結果是一組139,504個單基因序列,平均長度為1138 bp,N50為1773 bp,GC含量為39.09%(表S1)。
研究者透過對不同開花期(S1、S2和S3)的轉錄組進行成對比較,分析了差異表達基因(DEG) (圖2)。有4955個基因在S2中的表達明顯高於S1,3721個基因在S3中的表達高於S2。然而,有5058個基因在 S2 中的表達量明顯低於 S1,6837 個基因在 S3 中的表達量低於 S2 中的表達量(圖 2A)。 在S1 vs S2和S2 vs S3的成對比較中,共有2819個DEGs(圖2B),其中483個和911個DEGs同時上調和下調(圖2C,D)。

圖2.不同階段「Arctic Queen」花瓣轉錄組的DEG分析。A S1 vs S2 和 S2 vs S3 中上調和下調的 DEG 數量。 B S1 vs S2 和 S2 vs S3 中總 DEG 的韋恩圖。 C,D S1 vs S2 和 S2 vs S3 中上調和下調 DEG 的韋恩圖。
3 花青素生物合成途徑中的DEGs
為了探究花青素積累導致「Arctic Queen」花瓣在花後階段著色的分子機制,研究者進一步分析了與花青素生物合成相關的DEGs的表達譜 (圖3)。如圖3A所示, 在S1到S2期間,花青素生物合成途徑中結構基因的直系同源物(包括 CHS 、 CHI 、 F3H 、 F3'H 、 DFR 、 UF3GT 、 3MaT1 和 3MaT2 )同時上調,與花瓣中花青素的積累相關 (圖1)。這一結果表明,潛在的上遊轉錄因子可能在轉錄上調控花青素積累的多個結構基因。
因此, 研究者鑒定了多個編碼 MYB-like、bHLH 和 WD40 轉錄因子的 DEG。 圖3B顯示了代表性 MYBs 、 bHLHs 和 WD40s 的表達譜。從S1到S2, MYBs 的幾個直系同源物上調表達,包括CL13157.Contig2_All,CL1880.Contig1_All,CL4147.Contig2_All,CL4673.Contig1_All,Unigene1242_All,Unigene18139_All和Unigene42407_All(圖3B)。在圖3B中 bHLHs 的直系同源物中,只有CL5776.Contig3_All上調, WD40 (Unigene39656_All)的直系同源物上調。在這些基因中, CmMYB6( CL4673.Contig1_All同源物)和 CmbHLp( CL5776.據報道Contig3_All同系物)透過在菊花中形成復合物來促進花青素的生物合成 。此外,與其他調控基因相比, CmMYB6 上調具有較高的FPKM值(圖3B),表明其在衰老花瓣中花青素的積累中起著關鍵作用。
花青素的生物合成受經典MBW復合物的調控。根據上述DEGs分析, 研究人員推測 CmMYB6 (CL4673.Contig1_All同源), CmbHLp (CL5776.Contig3_All同源)和 CmTTG1 (Unigene39656_All同源)是MBW復合物的候選成員,在開花後階段調節花色 。因此, 參考先前的研究,研究者進行了Y2H測定和BiFC測定以檢測CmTTG1和CmMYB6/CmbHLp之間的交互作用 。 結果,CmTTG1 與 CmMYB6 和 CmbHLp 交互作用 (圖 S1A 和 B)。由於 CmMYB6 和 CmbHLp 形成蛋白質復合物,這提出了一個問題, 即 CmTTG1 是否消除了 CmMYB6 和 CmbHLp 之間的交互作用 。為此,按照Schwenk等的描述, 研究者進行了Y3H測定 (圖S1C)。與CmMYB6和CmbHLp共表達的酵母細胞可以在所選培養基上生長,但AD-T+BD-Lam組合不能生長。同時,添加CmTTG1對所選培養基上共表達CmMYB6和CmbHLp的酵母細胞的生長沒有影響(圖S1C), 表明CmTTG1不影響CmMYB6和CmbHLp之間的交互作用。因此,研究人員推斷 CmMYB6、CmbHLp 和 CmTTG1 在菊花中形成蛋白質復合物。
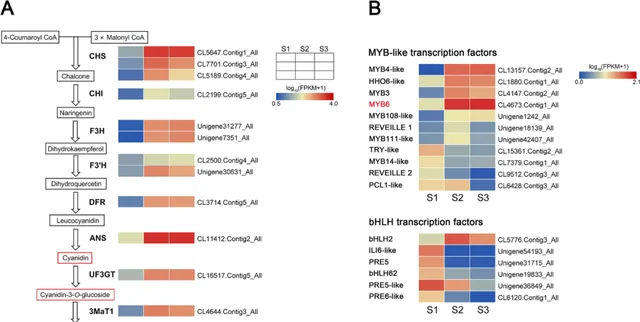
圖3.「Arctic Queen」花瓣中花青素生物合成途徑基因在3個花期的差異表達。A 菊花花秦素生物合成途徑中結構基因的表達模式。 B 編碼 MYB-like、bHLH 和 WD40 轉錄因子的基因的差異表達。熱圖描繪了歸一化的基因表現值(log10[FPKM + 1]),其中FPKM值代表了三個生物學重復的平均值。
4 酵母單雜交篩選和 CmNAC25 的分離
既往研究發現,由於 CmMYB#7 的表達變化,「Jimba」在自然栽培下偶爾會自發產生紅色的花瓣,即「 Turning red Jimba」。 在本研究中,研究者著重於「Arctic Queen」在開花後階段逐漸變成紅色的花瓣 。研究者驗證了 CmMYB#7 的表達,結果表明,CmMYB#7也參與了白菊花品種花後花瓣顏色變化的調控(圖S2)。 CmMYB#7 在盛花期(S1)表達量較高,進入花後期(S2–S3)後顯著下降(圖S2),初步說明了花青素在花後階段開始積累的原因 。然而,MBW蛋白復合物成員在花後階段表達逐漸增加和花青素積累的分子機制有待進一步探索。
為了探究菊花花瓣花後花青素生物合成的上遊調控機制,研究者利用菊花MBW復合體核心成員 CmMYB6 的啟動子進行酵母單雜交(Y1H)篩選 。從菊花基因組DNA中分離出1219 bp長的 CmMYB6 啟動子,作為誘餌插入pHIS2載體中,篩選「Arctic Queen」花瓣的cDNA文庫,並在轉錄組數據中透過原始細胞鑒定出幾個陽性複制(表S2)。在這些基因中, 只有1個NAC轉錄因子(Unigene39896_All)在S1到S2期間上調表達,與CmMYB6和花青素積累的上調相關 。因此,從「Arctic Queen」中複制了該基因的全長cDNA序列,稱為 CmNAC25 ,以供進一步鑒定。擴增後, CmNAC25 的 ORF 為 921 bp,編碼由 307 個胺基酸組成的蛋白質,預測分子量為 33.77 kDa,等電點(pI)為 5.10。
研究者進行了CmNAC25 的亞細胞定位分析 ,將 35S::GFP-CmNAC25 和 35S::D53-RFP 構建體(細胞核標記物)瞬時共轉化到本氏煙草葉片的表皮細胞中。空載體35S::GFP 和 35S::D53-RFP 結構作為對照。圖4A顯示,在細胞質和細胞核中均檢測到對照的GFP訊號,而僅在細胞核中檢測到35S::GFP-CmNAC25的GFP訊號。 結果表明,CmNA25位於細胞核內 。 序列比對分析表明,CmNAC25 在其 N 末端有一個保守的 NAM 結構域 (圖 4B), 這是 NAC (NAM/ATAF/CUC)轉錄因子家族中眾所周知的特定結構域 。 研究者在酵母系統中進行CmNAC25的轉錄活性分析,以pCL1的轉化為陽性對照,空載體pGBKT7為陰性對照。酵母細胞在SD/-H/A培養基中的生長表明CmNAC25(CmNAC25-FL,1-307aa)的全長具有轉錄活性。 相反,沒有硫解酶活性位點的截短CmNAC25(CmNAC25-S,1-275aa)沒有轉錄啟用活性(圖4C)。 為了分析其他植物物種中CmNAC25與NAC轉錄因子的系統發育關系,研究者構建了鄰接系統發育樹。 如圖4D所示,NAC家族分為幾組,與之前的研究相似。此外,CmNAC25與AtNAC25的親緣關系最為密切,屬於II組(圖4D)。 這些結果表明,屬於NAC家族的CmNAC25可能是一種轉錄啟用因子。

圖4. CmNAC25 的亞細胞定位、多序列比對、轉錄活性和系統發育分析。A CmNAC25在本氏煙草( Nicotiana benthamiana )葉片表皮細胞中的亞細胞定位分析。比例尺= 50 μm。 B 阿拉伯芥CmNAC25及其同系物的序列比對(AtNAC018,AT1G52880;ATNAC025,AT1G61110;ATNAC029,AT1G60490;ATNAC047,AT3G04070;AtNAC056, AT3G15510)、甘藍( Brassica oleracea )(BoNAC019,Bol039157)和蘋果( Malus domestica Borkh )(MdNAC42,MDP0000173636)。綠色框表示保守的 NAM 結構域。 C 酵母系統中 CmNAC25 的轉錄活性分析。用pCL1構建體轉化的酵母細胞作為陽性對照,用空載體pGBKT7轉化的酵母細胞作為陰性對照。SD/-H/A 表示 His 和 Ade 的合成營養缺陷型培養基。 D 不同物種NAC蛋白的系統發育分析。比例尺(1)表示分支長度。
5 CmNAC25 直接結合並啟用 CmMYB6 和 CmDFR 的啟動子
為了進一步探究CmNAC25在花色中的作用 , 研究者采用Y1H法對CmNAC25與 CmMYB6 啟動子或關鍵結構基因的交互作用進行了研究 ,結果表明, CmNAC25可以直接與 CmMYB6 的啟動子或關鍵結構基因 CmDFR 結合 (圖5A,B),而不是其他結構基因(圖 S3A)。如圖5A所示,與pGADT7-CmNAC25 構建體共轉化的酵母細胞和pHIS2-CmMYB6pro(−1219 bp)在含有或不含 50 mM 3-AT 的SD/-L/T/H 培養基上生長。然而,具有 CmMYB6 pro-1 (−1219 ~−400 bp) 或 CmMYB6 pro-2(−1219 ~−800 bp)插入的 pHIS2 載體的轉化體在提供 50 mM 3-AT 的 SD/-L/T/H 培養基上無法生長。 結果表明,CmNAC25與 CmMYB6 啟動子−400 ~ 0 bp區域結合 。根據先前的研究,具有CGT序列的NAC結構域蛋白的DNA結合基序是NAC結合序列的重要核心,其反向補體是ACG。 研究人員在 CmMYB6 的啟動子區−400 ~ 0 bp區域發現了兩個ACGT元件。接下來,電泳遷移率位移試驗(EMSA)表明,第一個突變ACGT元件的結合探針仍然存在。相反,當第二個或兩個ACGT元件發生突變時,結合的探針消失,表明CmNAC25直接結合位於-89~-85 bp的第二個ACGT元件上的 CmMYB6 啟動子 (圖5C)。圖5B 顯示,與 pGADT7-CmNAC25 構建體和 pHIS2-CmDFR pro (−1829 bp)、 pHIS2-CmDFR pro-1 (−1826 ~−400 bp)或 pHIS2-CmDFR pro-2(− 1826 ~ − 800 bp) 共轉化的酵母細胞無論是否含有50 mM 3-AT均能夠在SD/-L/T/H 培養基上生長。而含有 pHIS2-CmDFR pro-3(−1826 ~− 1300 bp)的轉化體的構建體在提供 50 mM 3-AT 的 SD/-L/T/H 培養基上無法生長。結果表明, CmNAC25在−1300 ~−800 bp 區域與 CmDFR 啟動子結合,該區域也含有一個 ACGT 元件,EMSA 表明 CmNAC25 可以直接在位於−839 ~−835 bp的第二個ACGT元件處結合 CmDFR 啟動子 (圖 S4)。由CmMYB6-CmbHLp蛋白復合物形成的MBW復合物對啟用菊花青素的積累至關重要,透過上述結果知道CmNAC25直接與 CmMYB6 的啟動子結合;此外, Y2H和BiFC測定結果表明 CmNAC25 不與 CmMYB6 或 CmbHLp 交互作用 (圖 S3B 和 C)。同時,當用CmNAC25代替CmTTG1時,Y3H測定顯示出類似的結果(圖S1C),結果進一步表明 CmNAC25和CmTTG1都不會影響CmMYB6和CmbHLp之間的交互作用 。
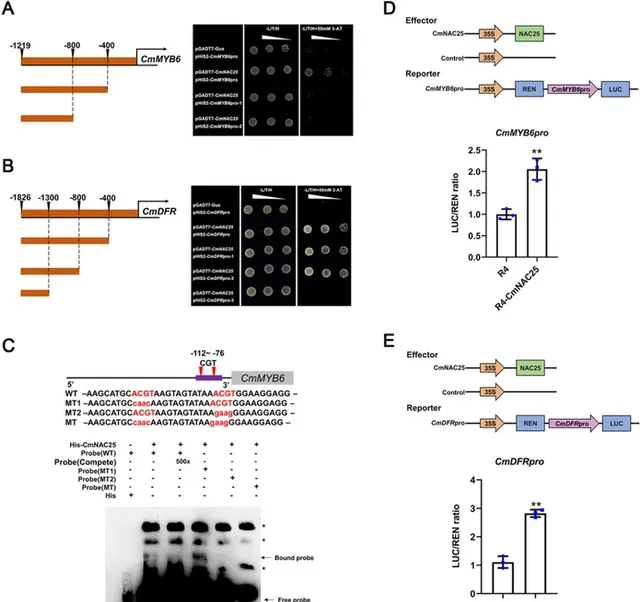
圖5. CmNAC25 啟用 CmMYB6 和 CmDFR 的啟動子。A,B Y1H 測定CmNAC25與 CmMYB6 或 CmDFR 啟動子不同片段之間的交互作用。使用與 pGADT7-Gus 和 pHIS2 構建體共轉化的酵母細胞作為陰性對照。SD/-L/T/H 表示 Leu、Trp 和 His 合成營養缺陷型培養基。 C EMSA測定表明,CmNAC25直接與位於-89~−85bp的ACGT元件處的 CmMYB6 啟動子結合。 *表示非特異性結合帶。 D,E 雙熒光素酶實驗表明,CmNAC25 啟用了 CmMYB6 和 CmDFR 的啟動子活性,以 CmMYB6 或 CmDFR 啟動子驅動的 LUC 作為報告基因。pORE-R4-35S::NAC25載體是效應子,空載體(pORE-R4)作為對照。對照組的LUC/REN比率設定為1。誤差線表示三個生物學重復的 SD。用星號表示的樣本表示顯著差異( p <0.05,t 檢驗)。
研究者對菊花原生質體進行雙熒光素酶測定,以進一步研究CmNAC25如何調控 CmMYB6 或 CmDFR 的表達。與對照組相比,35S::CmNAC25共表達的CmMYB6pro::Luc或CmDFRpro::Luc的LUC/REN比值顯著增加(圖5D,E)。這些結果表明,CmNAC25透過啟用 CmMYB6 和 CmDFR 的表達來正向調節花青素的生物合成。
6 CmNAC25的表達模式與不同菊花品種衰老花瓣中花青素的積累有關
為了探究CmNAC25是否透過促進 CmMYB6 和 CmDFR 在不同菊花品種中的表達來調控花青素的積累 ,研究者 以「Nannong Lvdong」和「Ibis Sunny」為研究物件 。與「Arctic Queen」類似,這兩個品種的花瓣在開花後階段也逐漸變紅(圖6A),花青素增加(圖6B)。 qRT-PCR分析顯示, CmNAC25 在「Nannong Lvdong」、「Ibis Sunny」和「Arctic Queen」花瓣中S1-S3的表達水平上調(圖6C),與表型一致。 此外, CmMYB6 和 CmDFR 的表達模式在開花後也呈上調趨勢(圖6D,E)。 這些結果進一步表明,CmNAC25作為花青素生物合成的正調節因子,在不同菊花品種中具有相似的分子調控機制,菊花在開花後逐漸變紅 。
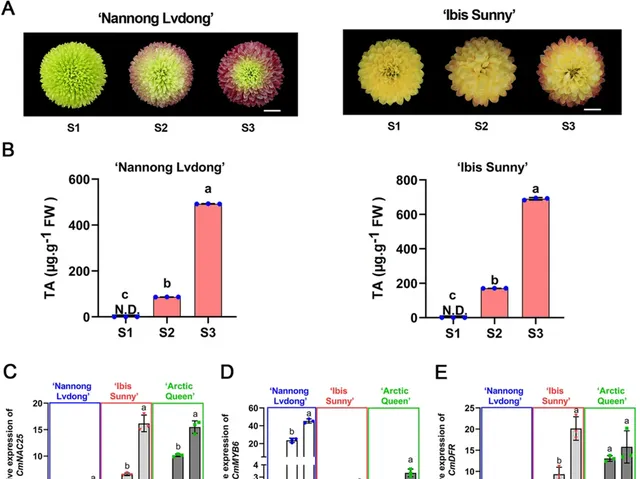
圖6. 不同品種花後花瓣中 CmNAC25 、 CmMYB6 和 CmDFR 的含量及表達模式。A 「Nannong Lvdong」和「Ibis Sunny」花瓣在開花後階段的表型。比例尺= 1cm。 B 「Nannong Lvdong」和「Ibis Sunny」花瓣中三個花期的總花青素含量(TA)。 C-E 「Nannong Lvdong」、「Ibis Sunny」和「Arctic Queen」花瓣中 CmNAC25 、 CmMYB6 和 CmDFR 的表達水平。誤差線表示三個生物學重復的 SD。小寫字母表示顯著差異( p <0.05,變方分析,Tukey校正)。
7 CmNAC25的過表達促進煙草花瓣中花青素的積累
為了證實CmNAC25在調節花青素生物合成中的作用,研究者使用農桿菌介導的方法將pORE-R4-CmNAC25載體轉化煙草( Nicotiana tabacum ) 。 T1代為4個過表達 CmNAC25 的基因改造品系,其中3個(21#、40#和45#)的花色比WT更紅 ,而其中一個的花色與WT相似(圖7和圖S5)。與WT相比,3個基因改造品系花色更紅(圖7A),花瓣中花青素含量增加,基因改造品系21#、40#和45#的花青素含量分別比WT高約72%、80%和54%(圖7B)。 qRT-PCR分析表明, CmNAC25 轉錄本僅在基因改造系中表達 (圖7C)。此外, 內源基因中 NtDFR 的表達水平在基因改造株系中誘導最為顯著(圖7D)。這些結果表明,CmNAC25是植物花青素生物合成的正調節因子。
圖7. CmNAC25 的過表達誘導煙草中的花色和花青素積累。A CmNAC25 過表達品系和WT植株的表型。 B WT和基因改造植物花瓣中的總花青素(TA)。 C 基因改造系和WT的轉錄本 CmNAC25。 N.D.代表未檢測。 D WT和基因改造植株花瓣中 NtCHS 、 NtCHI 、 NtF3H 、 NtDFR 和 NtANS 的表達水平。誤差線表示三個生物學重復的 SD。用星號表示的樣本表示顯著差異( p <0.05,t 檢驗)。
8 CmNAC25調控菊花花瓣中花青素的生物合成
為了進一步表征CmNAC25在菊花中的功能,研究者選擇具有可用遺傳轉化系統的菊花品種「Jinba」獲得過表達的 CmNAC25 和 RNAi-CmNAC25 基因改造株系 (圖8A)。如圖8A所示, 與WT相比,兩個 OE-CmNAC25 系4#和9#的花瓣呈現出更紅的顏色。 相比之下, 在 RNAi-CmNAC25 的兩個品系(23#和25#)中,在初始衰老階段(完全開花後10天)觀察到較淺的花瓣陰影。 此外,在過表達的 CmNAC25 植株的花瓣中檢測到的花青素含量顯著增加。相比之下, RNAi-CmNAC25 基因改造株系的花瓣中花青素含量低於WT的花瓣,這與表型一致(圖8B)。
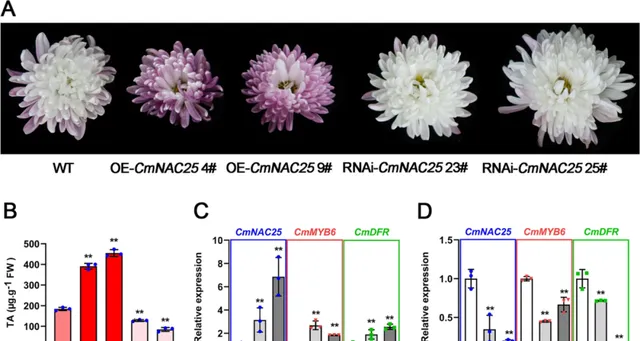
圖8. CmNAC25 的過表達和抑制影響了基因改造菊花「Jinba」的花瓣著色和花青素的生物合成。A WT和基因改造品系 OE-CmNAC25 4#、9#和 RNAi-CmNAC25 23#、25#在衰老初期的花表型。 B WT和基因改造植物花瓣中總花青素含量(TA)。 C CmNAC25 、 CmMYB6 和 CmDFR 在 OE-CmNAC25 基因改造株系和WT中的表達。 D CmNAC25 、 CmMYB6 和 CmDFR 在 RNAi-CmNAC25 基因改造株系和WT中的表達。 誤差線表示3個生物學重復的SD。用星號表示的樣品表示WT和基因改造品系之間的顯著差異( p <0.05,t檢驗)。
qRT-PCR分析表明 , 與WT相比, CmMYB6 和 CmDFR 的表達水平與 CmNAC25 表達一致,在兩個過表達的 CmNAC25 品系中顯著升高(圖8C) 。相比之下,這三個基因的表達水平在兩個 RNAi-CmNAC25 系中顯著下調(圖8D)。以上結果進一步表明, CmNAC25在花後階段透過促進菊花花瓣中 CmMYB6 和 CmDFR 的表達來正向調控花青素的生物合成。 此外,CmNAC25介導的基因改造「Jinba」中花青素的積累只發生在開花後階段。 完全開花階段過表達的 CmNAC25 品系仍為白色;這應歸因於 CmMYB #7的高表達在開花期破壞了CmMYB6-CmbHLp蛋白復合物,破壞了花青素的生物合成 。
此外,為 了獲得更多關於CmNAC25潛在下遊調控網路的資訊,研究者使用WT和 RNAi-CmNAC25 基因改造株系23#( RNAi23# )在初始衰老階段的花瓣進行RNA-Seq分析 (圖S6)。 在WT和 RNAi23# 花瓣之間的轉錄組成對比較中檢測到8120個DEGs。與WT相比, RNAi23# 中上調了5149個DEGs,下調了2971個DEGs(圖S6A) 。在花青素生物合成途徑中,包括 CmDFR 在內的大多數結構基因在 RNAi23# 中下調, RNAi23# 花瓣中的花青素少於WT(圖S6B)。 RNAi23# 花瓣中 MYB6 、 MYB114 、 MYB111 、 bHLH63 等多個轉錄因子編碼基因下調, EGL3 (bHLH)上調。然而,WT和 RNAi23# 之間 MYB#7 的表達水平沒有顯著差異(圖S6C)。 這些結果表明,在基因改造株系中,CmNAC25透過調控 CmMYB6 、 CmDFR 和其他基因來調控花青素的生物合成,而不是 MYB#7 。
討論
菊花作為一種重要的切花材料,其顏色具有很高的經濟價值。研究表明,菊花的粉紅色、紅色和紫色花瓣由不同含量的花青素提供。在一些菊花品種中,花瓣顏色在開花過程中發生變化,包括花瓣顏色的加深和花瓣顏色的褪色,這是由於花青素含量的變化而引起的,極大地影響了菊花的經濟價值。了解上述變化過程的分子機理對菊花的分子育種非常重要。
在花瓣衰老的過程中,會發生一系列生理指標的變化,以及花瓣顏色的變化。 對於一些觀賞植物,花藥開裂,花瓣顏色褪色;例如,芍藥「Coral Sunset」和「Pink Hawaiian Coral」的花色在開花後階段由粉紅色變為淡黃色,在湖北海棠Rehder的發育過程中,花朵由紅色變為白色。在現代月季中,花衰老伴隨顏色褪色,觀賞價值喪失。當菊花花瓣在開花後進入衰老階段時,發生的顏色變化分為兩類。一是花青素含量降低,花瓣顏色褪色;花青素的生物合成是一個耗能的過程,因為涉及的氧化還原過程需要高能量,在花後減少其生物合成可能是為了節省能源和延長開花期;另一種是花青素開始積累,花色逐漸變紅,如本研究選擇的植物材料,即「Arctic Queen」「Nannong Lvdong」,「Ibis Sunny」。研究人員發現花青素的逐漸積累導致了上述表型。花藥裂開決定了覓食者可以收集的可用花粉,因此蜜蜂等昆蟲的授粉發生在花藥裂開之後。這意味著花青素在開花後階段開始積累,花瓣逐漸變紅可能對吸引昆蟲傳粉者具有重要意義。此外, 植物衰老時會產生大量的活性氧(ROS),已知花青素可以清除自由基,因此花後階段花青素的積累也可能參與花瓣中ROS的清除 。
花青素是類黃酮生物合成途徑的產物,在該途徑中一系列結構基因的持續催化下產生 。先前的研究表明, 該通路受到經典MBW復合物的正調控,其特征是菊花中的MYB6-bHLp 。 MYB TFs(轉錄因子)是類黃酮生物合成途徑中結構基因的關鍵調節劑 。 不同階段對「Arctic Queen」樣品的轉錄組分析表明,與花青素生物合成和MBW復合物成員相關的結構基因的表達水平與花青素積累的增加一致 (圖1和圖3)。這表明,上遊潛在轉錄因子可能透過MBW復合物和一系列結構基因發揮作用。先前的研究表明,TFs透過MBW復合物調節花青素的生物合成;例如,HAT1與MYB75交互作用並幹擾MBW蛋白復合物,以抑制阿拉伯芥中 pap1-D 植物豐富的花青素表型。此外,PpMYB18是花青素和PA積累的負調節因子,可以與MYB活化劑競爭與bHLHs結合,從而幹擾MBW蛋白復合物。然而,到目前為止,透過MBW復合物起作用的TF在菊花中幾乎沒有特征。
研究人員表征了 CmMYB6 上遊的轉錄因子 CmNAC25 , 它可以透過促進 CmMYB6 和 CmDFR 的表達來作為花青素生物合成的正調節因子 。此外, 還對基因改造「Jinba」和WT進行了轉錄組分析。 在 RNAi-CmNAC25 基因改造株系中, CmNAC25 的表達顯著低於WT,不僅 CmMYB6 和 CmDFR 的表達水平顯著降低,而且其他花青素生物合成基因的表達水平也顯著降低(圖S6),因為CmMYB6-CmbHLp是花青素生物合成途徑的上遊正調節因子。同時,研究人員發現 RNAi-CmNAC25 基因改造株系中存在一些與WT相比差異表達的候選TFs,如幾種MYB TFs和bHLH TFs(圖S6)。這表明,盡管CmNAC25不與其他結構基因的啟動子結合,但它可能透過調節這些潛在的轉錄因子來影響這些基因的表達。
NAC(NAM、ATAF1/2和CUC2)蛋白是最突出的植物特異性TF家族之一,具有保守的N端NAM結構域。NAC TF已被證明可以調節多種生物學過程,包括枝條頂端分生組織的形成和維持、花的發育、對應激誘導開花誘導的控制、胚胎發育、激素訊號傳導和次級細胞壁合成的調節。CmNAC25 屬於 NAC 基因家族,其 N 末端具有保守的 NAM 結構域(圖 4B)。先前的研究表明,轉錄啟用結構域存在於C末端區域,而不是NAM結構域。研究人員的結果也說明了相同的事實,即截斷 C 末端 (CmNAC25-S) 後的 CmNAC25 序列沒有轉錄啟用活性(圖 4C)。系統發育分析表明,NAC TF家族規模龐大,包含若幹亞群,如圖4D所示,其中CmNAC25屬於II組,與AtNAC25親緣關系最為密切。另外還有兩個基因 BoNAC19 和 MdNAC42 ,它們被表征為花青素生物合成的調節因子,並且也屬於II組,它們與CmNAC25密切相關。在蘋果中,MdNAC42是控制紅肉蘋果花青素色素沈著的調控網路的重要正調節因子。然而, BoNAC019 的過表達透過降低阿拉伯芥中花青素基因的表達水平來減少花青素的積累。這表明,即使在同一組系統發育樹中, NAC基因作為花青素生物合成調節因子的功能也發生了分歧。在本研究中,CmNAC25 被表征為花青素生物合成的正調節因子。
在以往的研究中,Xiang等人發現「Jinba」在開花期出現白色的原因是R3 MYB轉錄因子CmMYB#7與CmbHLp交互作用,破壞了菊花花青素生物合成所必需的MBW蛋白復合物CmMYB6-CmbHLp,從而阻斷了白色花瓣中花青素的生物合成。 在開花後階段, CmMYB#7 的表達降低,CmbHLp被釋放形成CmMYB6-CmbHLp復合物,花瓣開始積累花青素,揭示了CmMYB#7在菊花蛋白水平上負調控MBW復合物形成的分子機制。 在本研究中, 研究者還發現,在「Arctic Queen」中,花青素積累的開始也可能是由 CmMYB#7 表達降低(圖 S2)和 MBW 蛋白復合物中 CmbHLp 成員的釋放引起的 (圖 9)。此外, 本研究首次表征了 CmMYB6 上遊的正調節因子 CmNAC25,並揭示了菊花開花後花瓣中花青素逐漸積累過程中轉錄水平的調控。 在 RNAi-CmNAC25 基因改造系中,與 WT 相比, CmMYB#7 沒有差異表達(圖 S6),這表明 CmNAC25 可能不是 CmMYB#7 的上遊。因此, 本研究闡明了啟用因子 CmNAC25 和阻遏蛋白 CmMYB#7 在花青素積累的協調調控中發揮不同的作用,誘導菊花在開花後階段變紅(圖 9)。

圖9. CmNAC25調控的花青素在花後階段的生物合成模型。 虛線框表示 CmNAC25 、 CmMYB6 、 CmbHLp 和 CmDFR 在盛花期的表達水平相對較低,而 CmMYB#7 在花後階段的表達水平相對較低。實心框表示 CmMYB#7 在盛花期高表達, CmNAC25 、 CmMYB6 、 CmbHLp 和 CmDFR 在開花後表達水平上調。
綜上所述,本研究探究了菊花後花瓣著色的分子機制。開花後階段花青素的逐漸積累表現為花瓣逐漸變紅。在開花後花瓣中上調的轉錄因子 CmNAC25 被證實位於 MBW 復合物成員 CmMYB6 和關鍵花青素生物合成基因 CmDFR 的上遊 。此外, 它透過直接或間接調控多個基因作為花青素生物合成的正調節因子 ,這被基因改造植物(包括煙草和菊花)的表型所認可。綜上所述,CmNAC25在花青素誘導的菊花花瓣著色中起著至關重要的作用。











