成功地將大分子( macromolecule)治療藥物透過血腦屏障(blood-brain barrier, BBB)遞送到中樞神經系統是神經系統疾病治療的主要挑戰。近年來,被稱為外泌體(exosome)的天然奈米顆粒(nanoparticle)被率先開發,並展示了其作為治療載體的潛力。外泌體的天然大分子遞送和靶向特性在siRNA全身遞送至大腦中得到了很好的例證。此外,外泌體的遞送似乎具有良好的耐受性。因此,這種新型天然奈米技術有可能透過血腦屏障進行全身藥物遞送,以治療一系列神經系統疾病
治療性蛋白質的遞送有望治療多種疾病。目前已有多種蛋白質療法套用於臨床,但它們多數局限於單複制抗體、肽類激素和細胞因子,往往透過與細胞質膜上的受體結合來發揮作用,其遞送有效性與安全性也存在不足。
同時,更多疾病是由細胞內特定蛋白的缺乏或功能障礙引起的,這些疾病的治療需要實作治療性蛋白質的細胞內遞送,但這一點目前仍然面臨著重重障礙。
Dong-Gyu Jo是成均館大學藥學院教授,他向我們介紹了當前蛋白質遞送面臨的3項重要挑戰:「首先是免疫系統對註射蛋白質的反應,這可能導致免疫原性效應,不僅降低治療效果,還會產生副作用;另一個重要挑戰是確保有效遞送跨越生物屏障,尤其是在治療艾爾茨海默病等神經退行性疾病時,需要跨越血腦屏障;此外,治療性蛋白質的生物利用度通常較低,在到達目標位置之前容易被迅速降解或清除,從而限制了治療效果。」
為了解決上述挑戰,設計出更高效、靶向性更強、更加可控的蛋白質遞送機制,Dong-Gyu Jo教授帶領團隊嘗試從外泌體(exosome)中尋找全新的遞送方案。在一項發表於近期【科學-轉化醫學】( Science Translational Medicine )的研究中,研究團隊開發出了基於外泌體的細胞內治療性蛋白遞送技術MAPLEX,並在小鼠實驗中證實了其有效遞送,並治療艾爾茨海默病的能力。

外泌體是由細胞自然分泌的奈米尺寸囊泡。「外泌體具有天然穿過生物屏障(包括血腦屏障)的能力,並且與脂質奈米顆粒等合成載體相比,觸發免疫反應的可能性較低。」 Dong-Gyu Jo表示,這些優勢讓外泌體有潛力成為治療性生物分子的奈米載體。
不過,目前使用外泌體的蛋白質遞送系統也存在待解決的悖論:要將蛋白質裝載到外泌體中,需要讓貨物蛋白與外泌體標記蛋白相融合;但另一方面,抵達目標位置後,貨物蛋白需要與外泌體標記蛋白分離,才能進入受體細胞、正常發揮作用。因此,需要設計工具讓貨物蛋白和外泌體標記蛋白在裝載時結合,但在遞送過程中切割。
為了精確控制兩者結合的時間與空間,確保貨物蛋白在進入靶細胞時能從外泌體膜中釋放,研究團隊創新性設計了一套光裂解系統。
具體來說,作者將光裂解蛋白mMaple3融合在貨物蛋白和外泌體標記蛋白CD9之間,從而實作第一個目標:將貨物蛋白裝載到外泌體中。這時的貨物蛋白-mMaple3-CD9雖然是結合狀態,但其中的紐帶mMaple3卻是一枚「定時炸彈」。作為光裂解蛋白,顧名思義,mMaple3可以被特定波長的光裂解。
於是,在提純融合蛋白後,研究團隊在給藥前透過450奈米的光誘導mMaple3裂解,這時貨物蛋白也自然與CD9分離,從外泌體膜釋放,實作了貨物蛋白的細胞內遞送!
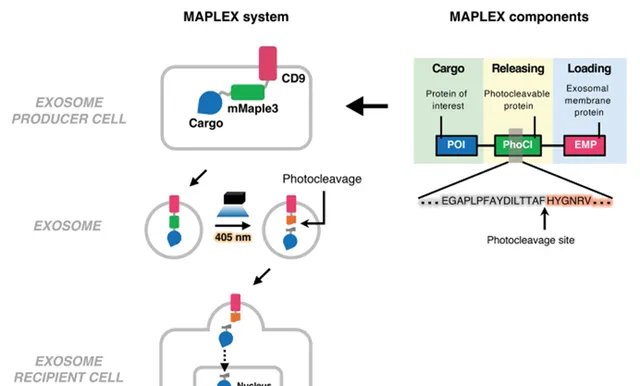
▲MAPLEX系統設計示意圖(圖片來源:參考資料[1])
Dong-Gyu Jo教授表示,這套系統確保了在細胞環境中正確啟用和定位,提高了蛋白質遞送的安全性和有效性。研究團隊將該系統命名為「mMaple3介導的蛋白質裝載到外泌體和從外泌體釋放」,簡稱MAPLEX。
隨後,研究團隊對MAPLEX的實際套用潛力進行了初步檢驗。前面說到,由於需要穿過血腦屏障,治療艾爾茨海默病的細胞內蛋白質藥物遞送尤為困難。我們知道,β-澱粉樣蛋白是艾爾茨海默病的致病蛋白之一,而Β位澱粉樣蛋白前體蛋白切割酶1(BACE1)是β-澱粉樣蛋白生成途徑的限速步驟,因此減少BACE1蛋白將有助於改善認知功能。
因此在這項實驗中,研究團隊使用MAPLEX,裝載的貨物蛋白是dCas9蛋白復合物與DNA甲基轉移酶3A催化結構域(D3A)的融合蛋白,其中dCas9還結合了靶向 Bace1 基因的單精靈RNA。由此,完整的貨物蛋白稱為sg Bace1 -dCas9-D3A。
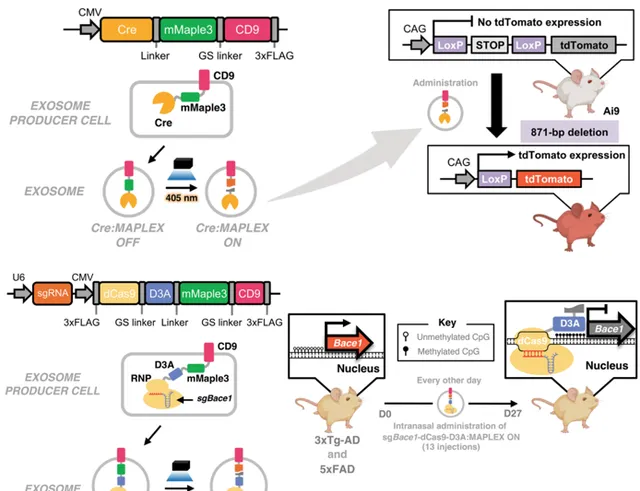
▲MAPLEX系統能夠對艾爾茨海默病小鼠模型進行體內的基因重組(上)與表觀遺傳(下)編輯(圖片來源:參考資料[1])
利用這套系統,研究團隊透過鼻腔分別給兩種艾爾茨海默病小鼠模型給藥。透過基因重組與表觀遺傳編輯,MAPLEX分別降低了兩種小鼠大腦中的 Bace1 表達和β-澱粉樣蛋白水平,成功實作了對腦細胞的蛋白質遞送,改善了小鼠的認知和記憶能力。
對於MAPLEX系統的未來前景,Dong-Gyu Jo教授表示,除了在神經退行性疾病中的已有發現,研究團隊正在探索其在罕見遺傳性疾病領域的套用前景:「對於這類疾病,精確的基因調控至關重要。而MAPLEX可以向受罕見遺傳病影響的細胞遞送基因編輯工具,從而提供潛在的靶向治愈手段。」
Dong-Gyu Jo教授繼續介紹道:「未來我們還將進一步完善該系統,並將其套用擴充套件到包括癌癥、自身免疫性疾病在內的一系列治療領域。我們還在尋求合作,以加速MAPLEX進入臨床試驗,希望它能成為治療多種疾病的多功能平台。」
參考資料:
[1] Jihoon Han et al. Engineered exosomes with a photoinducible protein delivery system enable CRISPR-Cas–based epigenome editing in Alzheimer’s disease. Science Translational Medicine (2024). DOI: 10.1126/scitranslmed.adi4830











