相信很多小夥伴,尤其是東北的小夥伴們都知道,在冬天氣溫非常低的時候,室外的鐵欄桿是甜的,南方的朋友建議去體驗一下哦~
是不是真的是甜的小編並不知道,但是,如果你嘗試了,就會很容易發現,自己的舌頭被粘在鐵欄桿上下不來了。
這是因為呀,人的舌頭表面有一層水(唾液),當舌頭接觸寒冷的鐵欄桿時,這層水會結冰,將舌頭和欄桿粘在一起。在夏天(或者其它時候)你吃雪糕的時候也可以有類似的體驗。

圖源 Pexels
那麽到現在我們可以得到一個結論:水只要到了凝固點以下,就會結冰。
這個結論對不對呢?其實是不對的。相反,我們會發現,在凝固點以下, 冰的表面也一定會有一層水 。
下面我們先討論正常的情況。

水-冰相變

還記得中學時學過,液態和固態是水的兩種 物態 ,他們可以相互轉化,水和冰之間的轉化就是 相(xiàng)變 。
所謂的相,指的就是被一定邊界包圍, 具有 確定而均勻的物理和化學性質 的系統或系統的一部份。
例如 液態水 具有確定而均勻的物理和化學性質, 是一個相 ;而 固態水 ,也就是冰,和液態水的性質不一樣,因此是 另外的相 ,此外,根據冰中水分子的排列方式不同,自然界的 冰也存在不同的相 。
為什麽會發生 相變 ?為什麽水會結冰?

圖源 Pixabay
我們知道,自然界的物質有自發地達到能量最低狀態的傾向,在低溫下,冰相對於水是 能量更低的狀態 ,因此水在低溫下會結冰。
但是這裏所說的能量並不是水或者冰的內能,在保持溫度和壓力恒定的情況下,系統的 吉布士自由能 。
吉布士自由能是溫度和壓力的函式,水和冰這兩種相有著不同的函式形式。在一個特定的溫度壓力下,平衡態系統只能 處在吉布士自由能較低的那個相 。兩個相的 吉布士自由能相等時 的溫度和壓力就是 相變 發生的條件。
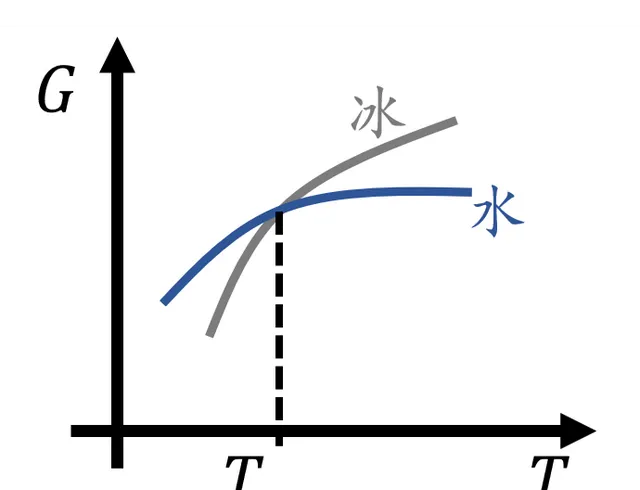
吉布士自由能隨溫度變化示意圖,平衡態下吉布士自由能低的相可以存在,兩相吉布士自由能相等時即為相變點
如果我們只考慮一個標準大氣壓的條件,那麽水的凝固點就是0℃,低於這個溫度,冰的吉布士自由能更低,因此平衡態下水這種物質以冰的形態存在,高於這個溫度,水的自由能更低,液態水可以存在。在0℃,冰和水可以共存。
溫度和壓力事實上是 兩個獨立的變量 ,但是當人們加上兩相吉布士自由能相等這樣一個限制條件之後,相當於把溫度壓力的取值限制在了二維空間的 一條曲線 上。

我們知道水還有氣相,也就是我們所熟知的水蒸氣。水蒸氣可以透過凝華、昇華與冰相互轉化,也可以透過液化、蒸發與液態水相互轉化,這也都是相變。
發生相變的溫度和壓力取值由參與相變的兩相吉布士自由能相等確定,這樣我們確定了 三條曲線 ,分別是氣相與液相的共存線稱為汽化線或液化線,固相與液相的共存線為溶解線或凝固線,氣相與固相的共存線為昇華線或凝華線,三條線相交與 三相點 ,三相點上 三相共存 , 有確定的溫度和壓力 。
水的相圖

壓力導致冰的熔化

我們仔細觀察水的相圖,註意到水和冰之間的共存線,也就是 溶解線 ,斜率是負的。這說明 隨著壓力增大 ,冰的 熔點逐漸降低 。
這一點在我們生活中就有套用。滑冰運動員穿著冰刀能夠在冰上高速運動,是因為冰刀與冰面的接觸面積很小,在重力的作用下形成了很大的壓力,導致冰刀下方局部冰面熔點降低發生熔化,形成一層水,這層水起到降低摩擦力的作用,讓運動員可以在冰上高速運動。

圖源 Wikipedia
那麽問題來了,冰刀下面的冰的熔點可以降低多少度,以至於在冰天雪地裏,冰可以熔化?
這時候我們需要引入描述一級相變的克拉柏龍方程式:
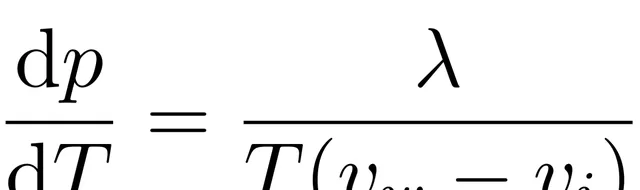
其中T, p分別是兩相共存曲線上的溫度的壓力,v和v分別是水和冰的單位品質的體積(就是密度的倒數),λ是冰的熔解熱,即單位品質的冰熔化成水所放出的熱量。
我們代入數據,在一個標準大氣壓下,水的熔點是273.15K,,且,熔解熱,這樣得到
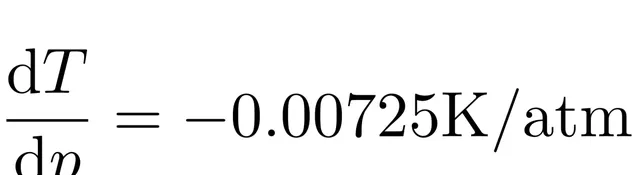
對於體重75kg的滑冰者,假設冰刀長度是10cm,寬度是1.5mm,那麽冰刀施加在冰面上的壓力不會超過50個大氣壓,按照線性關系進行估算,冰的熔點降低約0.4℃,查表可知在50個大氣壓下的冰的熔點約-0.37℃,我們的估算是可靠的。

圖源 Pexels
這種程度的熔點的降低相對於零下幾度甚至十幾度的冰天雪地實在是有些小了,所以 真正導致冰表面有一層水的並不是冰刀的壓力 ,而是...

預熔化

事實上,冰的表面就是會有一層水,即使是在溫度低於熔點的情況下。早在1842年, 法拉第 就透過實驗研究了這個現象。而直到今天,人們依然在探索這層水的形成機理以及這層水可能存在的最低溫度。我們把這種熔點之下,固體表面存在一層液態物質的這一現象稱為 預熔化 。
既然是研究水,我們不妨先考慮 真正的液態水 ,以及構成它的分子:水分子。我們知道水分子中一個氧原子透過共價鍵結合兩個氫原子,還可以借助氫鍵結合另一個水分子的兩個氫原子,因此在液態水中,水分子的排列是長程無序的,但是對於一個水分子附近的一小塊區域,每個氧原子總是被四個氫原子圍繞著。
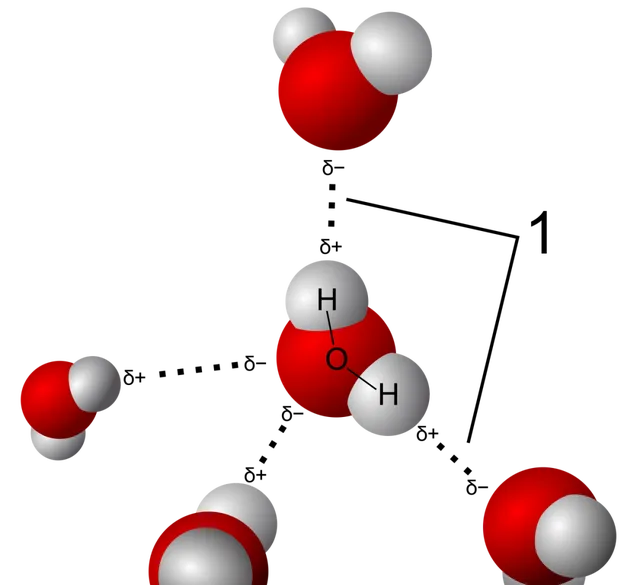
氫鍵示意圖 | 圖源 Wikipedia
上面的討論只適用於大量水的內部,水的表面也是這樣嗎?
物理學家外爾(Weyl)——不是那個外爾費米子的外爾——提出了這樣的假設:在水分子之間的電磁交互作用下水分子傾向於使 表面 沒有質子 , 氧位於最外層 ,而氫總是朝液體內部,這樣也就形成了一個「 電荷雙層 」,外面是負電荷,裏面是正電荷。
液態水的表面氧原子傾向於排在外側,氫原子傾向於排在內側,形成電荷雙層
於是我們可以進行推斷,冰和水是同一種分子,那麽冰的表面也傾向於使氧原子分布在外側而質子位於內側。但是,由於冰是固體,不像液體那麽容易 改變表面分子的排列方式 ,為了 降低表面能 ,冰的表面必須 存在一層水膜 ,這層水膜提供從有序的 晶格結構 到相對無序的「 電荷雙層 」之間的 過渡 。這部份水膜的能量會比相同條件下等量的水要高,但卻足以抵銷平整表面所產生的表面能。

加壓,還是加壓

上面外爾的分析定性地回答了為什麽冰的表面會有一層水,後續的研究人員又試圖從另一個角度出發,用定量的方式回答這個問題。
這位叫做Makkonen的物理學家仍然認為是 壓力導致冰表面的熔化 ,只不過這個壓力是 冰自己給自己加的 。

位於固體表面的分子只受到固體一側分子的吸重力,另一側沒有分子,因此不受力,大氣分子會提供一個力,但這個力太小了,我們就不考慮了。 表面分子作用力的不平衡 會形成一個將表面分子向內拉的力,這就是冰自己給自己加壓的壓力來源。

冰透過分子間交互作用給表面施加壓力
可以利用蘭納-瓊斯勢來計算分子交互作用帶來的壓力
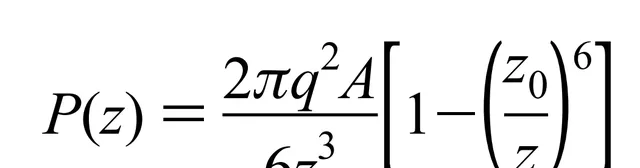
其中q 是每單位體積的分子數,A 是吸重力常數,z₀是塊體材料中分子之間的平衡距離。這個公式計算的是相距為z的兩個分子層之間的交互作用。
將每一層分子對表面分子的交互作用都加起來,得到
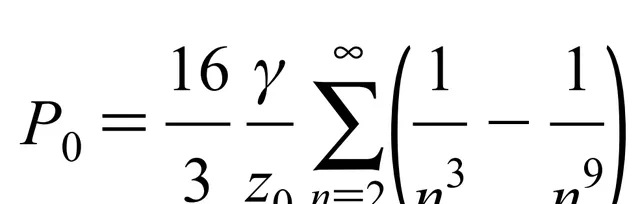
其中γ是冰的表面能,對n的求和是可以計算出約等於0.2,於是得到
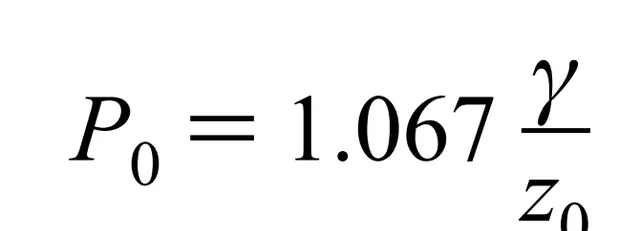
代入冰的數據,冰和真空的表面能,冰和水的表面能,,計算出冰-水界面的壓力要比冰-真空界面的壓力小180MPa,而這樣大的壓力足以使熔點降低13℃。
於是我們知道,如果冰表面沒有水,那麽分子間交互作用會 使表面分子感受到更大的壓力 ,從而使表面發生 熔化 ,而表面熔化之後這部份水降低了表面能,降低了壓力,於是內部的冰不再熔化。
所以冰的表面一定會有一層水,這層水不會結冰,裏面的冰也不會熔化。
現在我們回到文章開關的那個問題,既然冰上一定有一層水,而舌頭上的水遇到鐵欄桿會結冰,為什麽這裏的冰表面沒有水呢,為什麽舌頭會粘在鐵欄桿上,卻不是像冰刀一樣滑動呢?
這個問題留給讀者評論區討論吧~
參考資料
[1]Slater, Ben, and Angelos Michaelides. "Surface premelting of water ice." Nature Reviews Chemistry 3.3 (2019): 172-188.
[2]Weyl, W. A. "Surface structure of water and some of its physical and chemical manifestations." Journal of Colloid Science 6.5 (1951): 389-405.
[3]Makkonen, Lasse. "Surface melting of ice." The Journal of Physical Chemistry B 101.32 (1997): 6196-6200.
[4]Wettlaufer, J. S., and M. Grae Worster. "Premelting dynamics." Annu. Rev. Fluid Mech. 38 (2006): 427-452.
編輯:利有攸往











