引言
在真核細胞中,核小體是染色質的基本組成單元,其可以透過改變自身的定位、共價修飾組織蛋白及置換組織蛋白變體的方式來改變染色質的結構和調控基因表現。核小體的這些調控主要由染色質重塑復合物和組織蛋白修飾復合物來執行。 人源TIP60復合物 ( hTIP60 ) 是一個具有 17 個亞基的超大型復合物 (分子量約為1.7 MDa) ,它的獨特之處在於 同時擁有組織蛋白變體置換和組織蛋白乙酰化活性 。根據酶活和分子組成上的相似性,hTIP60被認為是酵母中 SWR-C復合物 (ySWR-C) 和 NuA4復合物 (yNuA4) 的融合物。之前的研究表明,hTIP60在多種生物學過程中發揮重要作用,包括轉錄調控、DNA修復、細胞周期控制和胚胎發育等,同時hTIP60的突變被認為與多種癌癥相關。
過往的研究報道了hTIP60 復合物的同源物如 ySWR-C、 yNuA4、hSRCAP-C等復合物的高分辨冷凍電鏡結構,從結構生物學的角度闡明了這些復合物結合受質核小體並行揮活性的機制,另外也有一些研究透過晶體學、核磁共振波譜 (NMR) 等技術對 hTIP60 復合物的部份亞基如YL1、YEATS4、MRG15-MRGBP、EPC1-MBTD1等進行了結構分析,而hTIP60 復合物的完整結構資訊一直處於空白狀態,因此目前該復合物的組裝及其結合核小體的模式仍然很不清楚。
2024年8月17日,復旦大學 徐彥輝 團隊在 Nature Communications 雜誌上線上發表了題為 Structure of the human TIP60 complex 的研究論文。該研究利用單顆粒冷凍電鏡技術,結合交聯質譜及體外生化功能分析 闡明了hTIP60復合物精細的分子組裝機制,並提出了該復合物作用於核小體的模型。

根據已有的關於hTIP60復合物的報道及其與yNuA4和ySWR-C復合物的同源性研究,由17個亞基組成的hTIP60復合物可被劃分為5個模組,其分別為含有Snf2家族ATPase結構域的motor 模組、調節性的ARP 模組、發揮乙酰化功能的HAT模組、含有多個組織蛋白修飾閱讀器的TINTIN (Trimer Independent of NuA4 for Transcription Interactions with Nucleosomes) 模組、以及用於結合轉錄啟用因子的TRRAP模組 (圖1) 。

圖1. 人源TIP60復合物的模組化組織和結構域示意圖 (Credit: Nature Communications )
徐彥輝課題組的這項工作報道了hTIP60復合物單體狀態下的冷凍電鏡結構,9.4 Å的整體冷凍電鏡密度圖表明該復合物主要由兩大部份構成,這兩部份被稱為核心亞復合物 (包括motor 模組及ARP模組) 和 TRRAP模組,它們透過一段柔性區域連線 (圖1a) ,隨後研究人員將這兩部份的分辨率均細化至3.2 Å (圖1b) 。這些結構表明EP400亞基作為hTIP60復合物的骨架蛋白,整合了復合物的motor 模組、ARP (actin-related protein) 模組和TRRAP 模組。在motor模組中,RUVBL1-RUVBL2六聚體是EP400亞基的ATPase結構域和YL1亞基組裝的剛性核心。在ARP模組中,ACTL6A-ACTB異二聚體和一個額外的ACTL6A 亞基透過疏水作用與EP400 亞基的HSA螺旋進行接觸;而亞基 DMAP1、EPC1和EP400之間的交互作用網路增強了ACTL6A-ACTB異二聚體和EP400-HSA之間的結合。在TRRAP模組中,EP400亞基的 SANT結構域及其C端區域與TRRAP亞基存在廣泛的交互作用界面。總體來看,ARP模組與motor模組之間的連線非常穩定,而其與TRRAP模組之間的連線非常靈活,這是hTIP60復合物特有的結構特征。
除了上述已經確定的模組外,hTIP60 復合物的整體冷凍電鏡密度圖中TRRAP模組和核心亞復合物之間還存在了一些較弱的密度,這些密度可能屬於hTIP60復合物其他的模組,包括HAT模組和TINTIN模組 (圖2a) 。因此在hTIP60復合物中,其HAT模組、TINTIN模組和TRRAP模組都以靈活的方式連線到核心亞復合物中,這種結構上的可塑性可能有助於該復合物在細胞中辨識復雜的染色質環境並找到合適的受質。
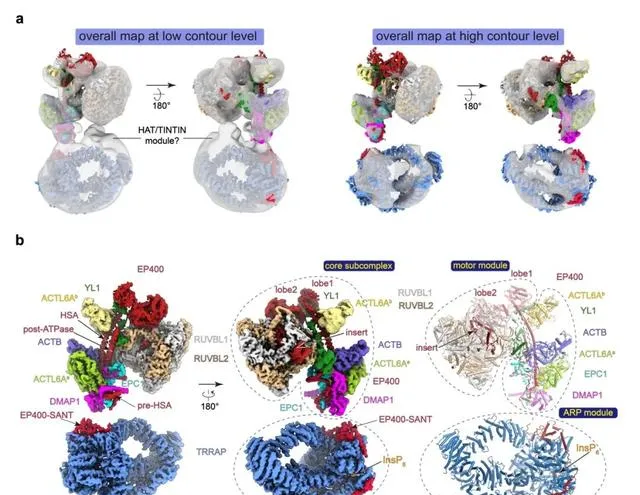
圖2. 人源TIP60復合物單體的結構:(a). hTIP60 復合物在低輪廓水平(low contour level,左)和高輪廓水平(high contour level,右)的整體冷凍電鏡密度圖。(b). 人源TIP60復合物單體狀態下的冷凍電鏡重構密度圖及三維模型。 (Credit: Nature Communications )
此外,該研究還報道了與核小體結合的hTIP60復合物的較低分辯率的冷凍電鏡結構,該結構顯示核小體結合在hTIP60復合物的核心亞復合物和TRRAP模組之間 (圖3) ,值得註意的是,在對hTIP60-核小體復合物的冷凍電鏡數據進行仔細的分析後,研究人員並未觀察到hTIP60的核心亞復合物像其他重塑復合物那樣 (即催化亞基的ATPase結構域抓住核小體的DNA以進行染色質重塑) 結合核小體的構象。
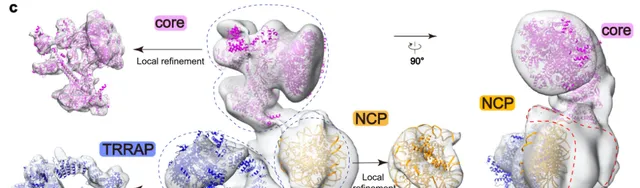
圖3. 核小體結合狀態下的人源TIP60復合物的冷凍電鏡重構密度圖及模型(Credit: Nature Communications )
綜上所述, 該研究揭示了hTIP60 復合物的 motor 模組、ARP 模組和 TRRAP 模組高分辨的結構資訊,闡明了該復合物的分子組裝機制及各模組之間的交互作用模式;並首次報道了和核小體結合的hTIP60復合物的冷凍電鏡重構密度圖,從結構生物學的角度對該復合物如何與核小體作用提供了見解,為繼續探索hTip60復合物作用於染色質並調控基因表現的機制提供了線索。
參考文獻
https://www.nature.com/articles/s41467-024-51259-z
責編 |探索君
排版|探索君
文章來源|「BioArt」
End











