引言
星形膠質細胞是哺乳動物大腦中數量最多的細胞型別,具有為神經元提供結構支持、維持代謝平衡、調節突觸功能等重要作用 。此外,星形膠質細胞在大腦受損或疾病狀態下會發生反應性變化。然而,有一小部份星形膠質細胞位於成年大腦的特定區域,如側腦室下區(ventricular–subventricular zone, vSVZ),這些星形膠質細胞表現出類似神經幹細胞(neural stem cells, NSCs)的能力,能夠分化為神經元和膠質細胞。這一現象表明, 星形膠質細胞在某些條件下具有可塑性,可被重新編程為具有幹性(stemness)的細胞 。然而,普通實質星形膠質細胞與靜止神經幹細胞在轉錄組上高度相似,盡管它們的功能截然不同。如何透過分子機制對幹性進行編碼,仍是未解之謎。
9月4日 Nature 的研究報道「 DNA methylation controls stemness of astrocytes in health and ischaemia 」,透過單細胞RNA測序(single-cell RNA sequencing, scRNA-seq)和單細胞甲基化組測序(scNMT-seq)等技術,對健康和缺血狀態下成年小鼠紋狀體和皮質的星形膠質細胞、神經幹細胞及其後代進行了深入分析, 揭示了DNA甲基化在星形膠質細胞向幹性轉變中的核心作用 。研究發現, 神經幹細胞的功能依賴於星形膠質細胞基因的甲基化,以及幹細胞相關基因的去甲基化。這一過程尤其在大腦受缺血損傷時表現明顯,缺血會誘導紋狀體星形膠質細胞獲得幹性,而這一轉變需要甲基轉移酶DNMT3A的介導 。如果缺乏DNMT3A,缺血性損傷將無法觸發星形膠質細胞的幹性啟用,進一步證明DNA甲基化在幹性調控中的關鍵作用。
研究表明,DNA甲基化的動態變化不僅在胚胎發育中發揮重要作用,同樣也是成年神經幹細胞分化過程中的重要調節機制。這一發現為再生醫學提供了新視角,表明透過調控DNA甲基化,可以促進神經再生,進而為大腦損傷後的修復提供潛在治療手段。

星形膠質細胞是中樞神經系統中最豐富的細胞型別,盡管它們長期以來被認為主要負責結構性支持和代謝功能,但近年來的研究揭示了它們在神經再生中的潛在作用,尤其是在受到損傷時。這些膠質細胞具備一定的可塑性,能夠在特定條件下轉變為神經幹細胞(neural stem cells, NSCs),這種轉化過程與表觀遺傳調控密切相關,特別是DNA甲基化(DNA methylation)在其中發揮了關鍵作用。
哺乳動物成年大腦中存在有限的神經生成(neurogenesis)區域,主要包括側腦室下區(ventricular–subventricular zone, vSVZ)和齒狀回(dentate gyrus)。在vSVZ區域,星形膠質細胞不僅可以在健康狀態下表現為支持性細胞,還可以在損傷條件下獲得神經幹性(stemness),成為神經生成的主力軍。然而,大多數實質性的星形膠質細胞,如位於紋狀體(striatum)和皮質中的細胞,通常不具備這種能力,如何透過表觀遺傳機制調控這一過程成為研究的重點。
為了深入研究DNA甲基化在星形膠質細胞幹性中的作用,研究團隊采用了單細胞核小體、甲基化組和轉錄組聯合測序技術(single-cell nucleosome, methylome and transcriptome sequencing, scNMT-seq )。這種技術可以同時捕獲單個細胞的基因表現、DNA甲基化以及染色質可及性(chromatin accessibility),為深入分析細胞命運的表觀遺傳調控提供了強有力的工具。研究物件為成年小鼠紋狀體和vSVZ區域的GLAST+星形膠質細胞以及神經元前體(neuroblasts),這些細胞被分離並進行單細胞測序分析。
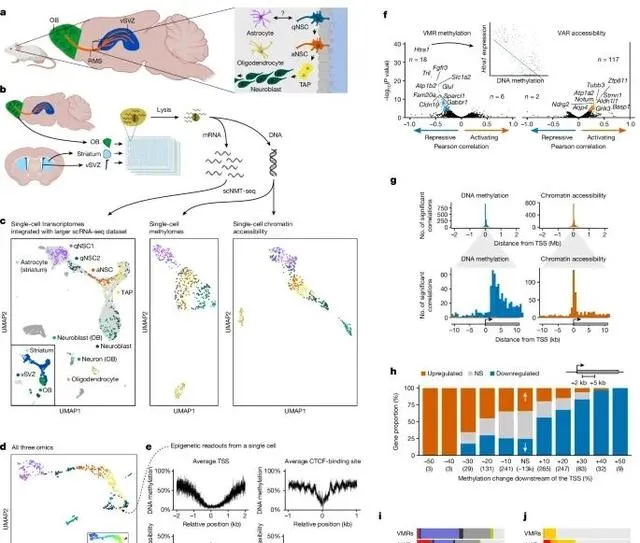
神經幹細胞譜系中的轉錄組、甲基化組和染色質可及性之間的相互關系,揭示了這些分子層面的變化在神經幹細胞分化過程中的作用 (Credit: Nature )
成年NSC譜系的示意圖: 圖a展示了位於側腦室下區(vSVZ)的神經幹細胞譜系,顯示了神經幹細胞如何從靜止狀態轉變為活躍狀態,並進一步分化為中間放大祖細胞(TAPs)、神經母細胞(neuroblasts)以及神經元。
實驗流程和分析的腦區: 圖b展示了實驗流程,研究透過scNMT-seq(單細胞核小體、甲基化組和轉錄組聯合測序)技術從vSVZ、嗅球(olfactory bulb)和紋狀體中獲取三組學數據,分析這些腦區中的不同細胞型別。
分子層面的單細胞聚類結果: 圖c透過UMAP降維分析顯示了不同細胞型別在轉錄組、甲基化組和染色質可及性三層數據中的分布,分別標記了靜止神經幹細胞(qNSCs)、活躍神經幹細胞(aNSCs)、TAPs、神經母細胞和神經元。
不同細胞型別的譜系順序: 圖d展示了細胞沿著譜系的偽時序排序,顯示了從靜止神經幹細胞到神經元分化的動態過程,並結合了三層分子數據對細胞狀態的區分。
啟動子和CTCF結合位點的甲基化與染色質可及性: 圖e展示了在一個典型神經母細胞中,基因啟動子和CTCF結合位點附近的甲基化和染色質可及性水平,顯示了在這些區域甲基化降低且染色質開放。
基因表現與表觀遺傳特征的相關性: 圖f顯示了基因表現與變異甲基化區域(VMRs)和變異可及性區域(VARs)之間的相關性,發現基因表現通常與其下遊區域的甲基化水平相關聯,說明了這些表觀遺傳特征在基因調控中的作用。
DNA甲基化與神經幹性相關基因的調控
研究表明,在健康狀態下,星形膠質細胞中的DNA甲基化會抑制與神經生成相關的基因表現,維持其膠質細胞的特性。然而, 在缺血性損傷(ischemic injury)發生時,DNA甲基轉移酶DNMT3A的表達增加,導致神經生成相關基因去甲基化(demethylation),從而啟用這些基因,促進星形膠質細胞向神經幹細胞的轉化 。
DNMT3A缺失的星形膠質細胞在缺血性損傷下未能有效啟用神經生成過程,表明DNMT3A在損傷修復和幹性啟用中的關鍵作用。研究還發現,與神經生成相關的基因去甲基化顯著增強,DNA甲基化在控制星形膠質細胞命運轉換中的作用得到了進一步證實。
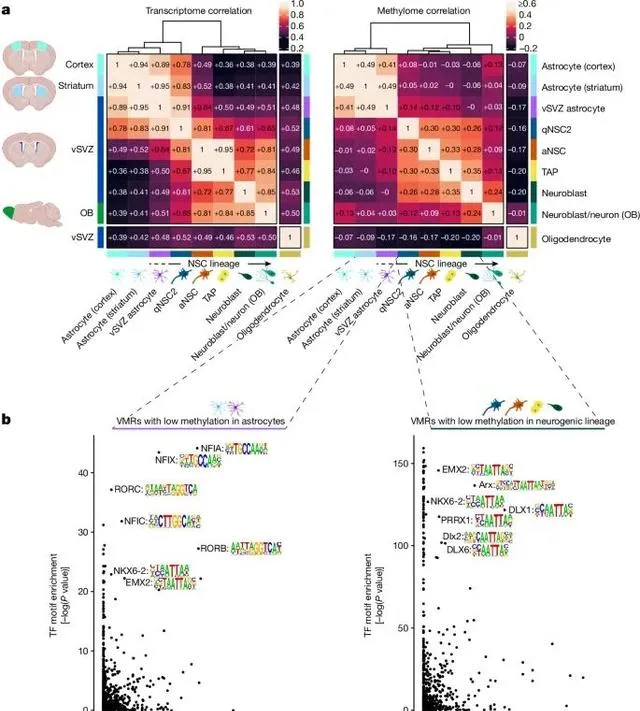
盡管神經幹細胞與普通星形膠質細胞在基因表現上相似,但它們透過獨特的DNA甲基化模式實作了功能上的區分 (Credit: Nature )
基因表現與DNA甲基化的差異: 圖a展示了不同細胞型別(包括vSVZ區域的星形膠質細胞、紋狀體的星形膠質細胞和神經幹細胞)的基因表現和DNA甲基化的相關性矩陣和層次聚類分析。盡管神經幹細胞和星形膠質細胞在基因表現方面高度相似,但它們在DNA甲基化模式上存在明顯差異,尤其是qNSC1階段(靜止神經幹細胞)與普通星形膠質細胞的DNA甲基化模式相似,而qNSC2階段(活躍神經幹細胞)則與神經幹細胞譜系的其他細胞更加接近。
VMR(變異甲基化區域)的轉錄因子結合位點富集: 圖b展示了在星形膠質細胞和神經幹細胞中,低甲基化區域(VMRs)與轉錄因子結合位點的富集情況。研究發現,在星形膠質細胞中,這些區域富集了NFIA和NFIX等轉錄因子的結合位點,這些因子已知與星形膠質細胞的分化有關;而在神經幹細胞中,OLIG2等轉錄因子的結合位點則更為富集,這些因子與神經幹細胞的分化和譜系決定密切相關。
DNA甲基化與細胞狀態的關聯: 圖a中的層次聚類分析揭示了盡管神經幹細胞與星形膠質細胞的基因表現相似,但在DNA甲基化層面,神經幹細胞表現出獨特的甲基化模式,這種差異主要出現在qNSC2階段,表明該階段的細胞正在經歷表觀遺傳重塑,逐步從星形膠質細胞轉變為神經幹細胞。
特異性甲基化的作用: 圖中還展示了不同細胞型別特異性低甲基化區域(VMRs)的分布,發現神經幹細胞中的這些低甲基化區域與神經元生成相關基因如Ascl1和Dlx1等密切相關,而星形膠質細胞中的低甲基化區域則與細胞代謝和離子運輸相關基因如Slc1a2和Glul等相關。這些結果表明,DNA甲基化在細胞命運決定和功能差異中起著關鍵作用。
神經幹細胞和星形膠質細胞的表觀遺傳差異
研究透過單細胞多組學技術分析了神經幹細胞和星形膠質細胞的轉錄組、DNA甲基化組和染色質可及性。結果顯示,神經幹細胞的DNA甲基化水平與星形膠質細胞顯著不同,神經幹細胞中的去甲基化過程特別活躍,與其幹性相關基因的表達增強密切相關。
此外,研究發現缺血性損傷顯著改變了紋狀體中星形膠質細胞的DNA甲基化模式,特別是與神經生成相關的基因區域。去甲基化的增強使得這些細胞能夠進入神經生成途徑,而這一過程依賴於DNMT3A。
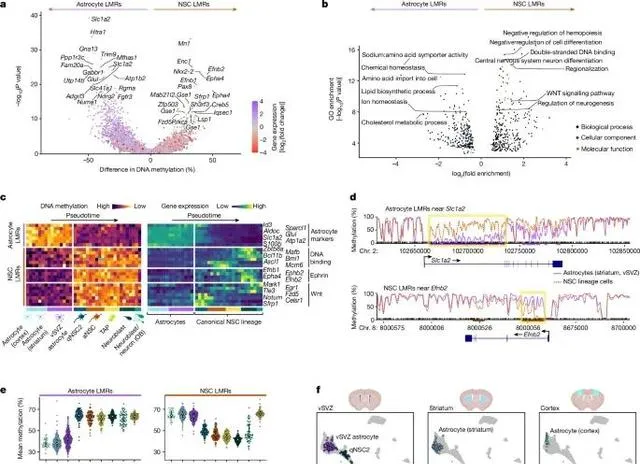
神經幹細胞透過特異性DNA去甲基化,啟用了神經生成相關基因,形成了促神經生成的甲基化組,這一表觀遺傳特征將它們與普通星形膠質細胞明顯區分開來 (Credit: Nature )
神經幹細胞與星形膠質細胞的DNA甲基化差異: 圖a透過DNA甲基化組分析顯示,神經幹細胞和普通星形膠質細胞在特定基因區域的甲基化模式存在顯著差異。神經幹細胞的低甲基化區域主要集中在與神經生成相關的基因上,而星形膠質細胞則在非神經生成基因區域保持高甲基化。這些差異表明,神經幹細胞的DNA甲基化組特征為其神經生成功能提供了基礎。
特定基因的DNA甲基化狀態分析: 圖b展示了多個與神經生成密切相關的基因,如Neurog2和Ascl1,在神經幹細胞中的DNA甲基化水平顯著降低,表明這些基因的去甲基化與神經幹細胞的活化和神經生成能力相關。同時,圖中還展示了這些基因在普通星形膠質細胞中的高度甲基化狀態,暗示這些細胞無法啟用神經生成通路。
甲基化差異區域(DMRs)分析: 圖c進一步分析了神經幹細胞與星形膠質細胞之間的甲基化差異區域,發現神經幹細胞中特異性低甲基化區域與神經生成和神經發育相關基因密切相關。這些低甲基化區域包括與神經元分化、軸突生長和神經突觸形成相關的基因,如Dlx2和Mapt,而星形膠質細胞則表現出這些基因的高甲基化狀態。
DNA甲基化與細胞功能的關聯: 圖d展示了神經幹細胞和星形膠質細胞的基因表現與DNA甲基化之間的關聯,顯示出神經幹細胞中低甲基化的基因通常與神經元生成和分化相關。這些基因在星形膠質細胞中被甲基化抑制,進一步說明了DNA甲基化在細胞命運決定中的重要作用。
促神經生成的DNA甲基化模式: 圖e強調了神經幹細胞中富集的低甲基化區域,特別是在神經幹細胞活化階段,DNA去甲基化促進了神經生成相關基因的表達。與此同時,星形膠質細胞的甲基化模式則維持了其支持性細胞的功能,未表現出神經生成的潛力。
不同狀態下星形膠質細胞的轉錄組和DNA甲基化模式
透過對健康與缺血狀態下的細胞進行比較,研究揭示了星形膠質細胞和神經幹細胞在不同狀態下的表觀遺傳特征。特別是,DNA甲基化在靜止狀態下能夠釘選星形膠質細胞的膠質細胞命運,抑制神經生成相關基因的表達;而在缺血性損傷時,去甲基化則解除了這種釘選,使得細胞能夠轉變為神經幹細胞,參與損傷修復。
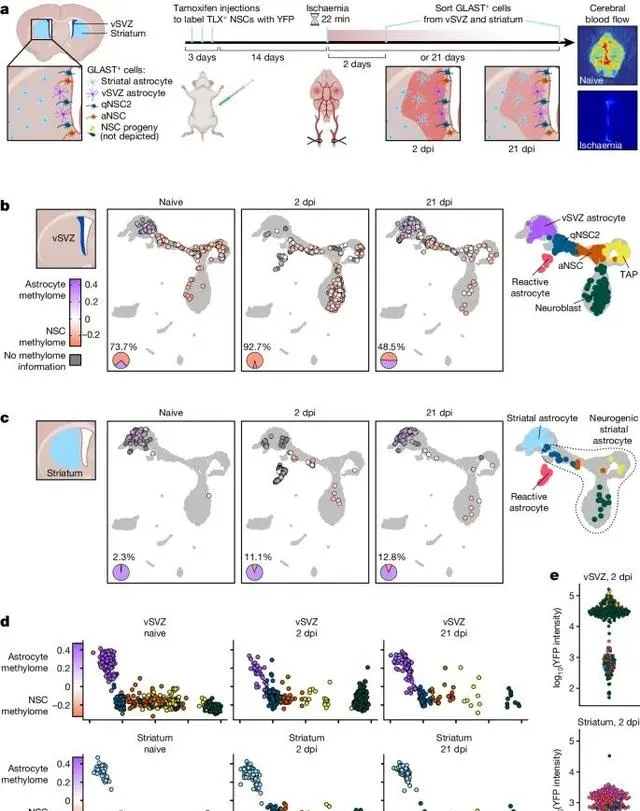
缺血性損傷能夠在紋狀體星形膠質細胞中誘匯出類似神經幹細胞的DNA甲基化組,促使這些細胞獲得神經生成的能力 (Credit: Nature )
缺血性損傷後的DNA甲基化變化: 圖a展示了在缺血性損傷後,紋狀體星形膠質細胞的DNA甲基化模式發生顯著變化,逐漸趨向於神經幹細胞特有的甲基化組。這表明,缺血性損傷能夠啟用紋狀體星形膠質細胞的可塑性,使其具備類似神經幹細胞的潛力。
偽時序分析揭示星形膠質細胞向神經幹細胞的轉變: 圖b透過偽時序分析(pseudotime analysis)展示了缺血損傷誘導下星形膠質細胞的逐步轉變過程。該圖顯示,隨著偽時序的推進,星形膠質細胞的表觀遺傳特征逐漸向神經幹細胞靠攏,標誌著其獲得了幹性特征。
神經幹細胞相關基因的去甲基化: 圖c展示了在缺血性損傷後,紋狀體星形膠質細胞中的神經生成相關基因(如Ascl1、Dlx2)的去甲基化水平顯著升高。這些基因的去甲基化與其表達的上調一致,說明DNA去甲基化在神經生成過程中起到了至關重要的作用。
DNMT3A在損傷修復中的作用: 圖d探討了甲基轉移酶DNMT3A在這一過程中扮演的關鍵角色。研究發現,缺乏DNMT3A的紋狀體星形膠質細胞在缺血性損傷後未能有效啟用神經幹細胞特征的DNA去甲基化,這表明DNMT3A是損傷誘導神經幹細胞表觀遺傳變化的必要條件。
DNA甲基化的動態變化: 圖e展示了不同基因在損傷後DNA甲基化的動態變化,神經生成相關基因的甲基化水平在缺血後明顯降低,而與星形膠質細胞功能相關的基因仍然維持較高的甲基化狀態,進一步證明了DNA甲基化在細胞命運決定中的重要調控作用。
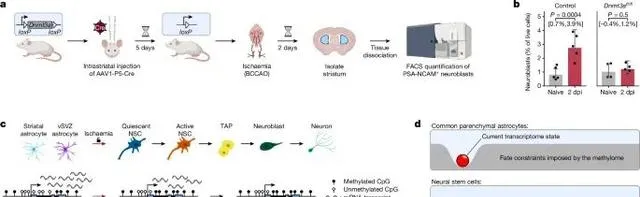
在Dnmt3a缺失的小鼠中,盡管發生了缺血性損傷,神經生成過程未能啟動 (Credit: Nature )
DNMT3A缺失對神經生成的影響: 圖a展示了在野生型(WT)小鼠和Dnmt3a缺失小鼠中,缺血性損傷後神經生成的情況。研究發現,在野生型小鼠中,缺血性損傷能夠有效誘導紋狀體星形膠質細胞轉變為神經母細胞(neuroblasts)並最終生成神經元。然而,在Dnmt3a缺失的小鼠中,這一過程被顯著抑制,顯示出DNMT3A的缺失阻礙了神經生成的發生。
神經母細胞和神經元標記物的表達: 圖b透過免疫染色分析了神經母細胞標記物(如DCX)和神經元標記物(如NeuN)的表達水平。結果顯示,在野生型小鼠中,這些標記物在缺血損傷後顯著增加,表明有更多的神經母細胞和新生神經元生成;而在Dnmt3a缺失小鼠中,這些標記物的表達幾乎沒有增加,進一步支持了神經生成未能有效發生的結論。
細胞譜系的變化分析: 圖c透過細胞譜系追蹤分析(lineage tracing)展示了缺血損傷後不同細胞型別的變化。在野生型小鼠中,紋狀體星形膠質細胞逐步轉變為神經幹細胞,並進一步分化為神經母細胞和神經元;但在Dnmt3a缺失小鼠中,這種細胞命運轉變顯著受阻,星形膠質細胞未能成功啟用神經幹細胞譜系。
損傷修復中的DNA甲基化作用: 圖d分析了DNMT3A在DNA甲基化調控中的作用,結果顯示,DNMT3A缺失阻止了與神經生成相關基因的去甲基化,特別是在缺血損傷後,這些基因未能透過DNA去甲基化啟用。因此,Dnmt3a缺失小鼠中的神經生成通路被抑制。
這些發現揭示了DNA甲基化在調控星形膠質細胞幹性中的核心作用。研究表明,DNA甲基化不僅決定了細胞的當前命運,還可能成為未來細胞命運的「藍圖」,在特定條件下可以透過表觀遺傳重塑來實作細胞命運的改變。
此外,這一過程的發現為再生醫學提供了新的方向。透過調控DNA甲基化,可以在疾病或損傷後啟用星形膠質細胞的神經生成能力,從而促進神經再生。這為中風、神經退行性疾病等患者提供了潛在的治療策略。
盡管研究表明DNA甲基化在星形膠質細胞幹性獲得中的重要作用,但仍有一些問題值得進一步探討。例如,DNA甲基化是如何在分子水平上驅動神經幹細胞的啟用?是否可以透過藥物或基因編輯技術幹預這一過程,從而提高治療效果?
未來的研究可以透過使用如dCas9的表觀遺傳編輯工具來靶向特定基因區域,測試是否可以透過直接調控DNA甲基化來影響細胞的命運轉換。這種方法不僅可以用於治療腦損傷,還可以用於癌癥治療,透過控制星形膠質細胞的命運選擇來影響腫瘤的發展。
該研究透過單細胞多組學技術揭示了DNA甲基化在星形膠質細胞向神經幹細胞轉化中的核心作用。研究表明,DNA甲基化透過調控與神經生成相關基因的表達,決定了細胞的命運轉換,並且這一過程在損傷修復中至關重要。未來的研究可以進一步探索如何透過調控DNA甲基化來促進神經再生,為再生醫學和神經疾病治療提供新的方向。
參考文獻
Kremer LPM, Cerrizuela S, El-Sammak H, Al Shukairi ME, Ellinger T, Straub J, Korkmaz A, Volk K, Brunken J, Kleber S, Anders S, Martin-Villalba A. DNA methylation controls stemness of astrocytes in health and ischaemia. Nature. 2024 Sep 4. doi: 10.1038/s41586-024-07898-9. Epub ahead of print. PMID: 39232166.
https://www.nature.com/articles/s41586-024-07898-9
責編 |探索君
排版|探索君
轉載請註明來源於 【生物探索】
End











