據新京報報道,美國食品和藥品監督管理局(FDA)近日釋出訊息,以最高級別召回飛利浦旗下多款呼吸機產品。被召回的產品主要用於治療阻塞性睡眠呼吸暫停症候群,因呼吸機故障警報裝置失效,可能導致治療中斷或失敗,還可能導致脆弱患者通氣不足、低氧血癥、高碳酸血癥、呼吸衰竭或死亡。
經FDA確認, 目前共有911起報告與召回事件有關,其中已有7人死亡。

致7人死亡
多款呼吸機被召回
根據報道,美國食品和藥品監督管理局近日釋出訊息,飛利浦偉康公司更新了旗下多個呼吸機產品(BiPAP V30, BiPAP A30, BiPAP A40 )的使用說明。此舉與其多個呼吸機產品召回有關。
早在今年3月份,飛利浦偉康公司向所有受到影響的客戶發出緊急醫療器械召回通知。由於呼吸機故障警報裝置故障,可能導致治療中斷或失敗,飛利浦偉康公司正在更新V30、A30、A40呼吸機的使用說明,故障還可能潛在導致脆弱患者通氣不足、低氧血癥、高碳酸血癥、呼吸衰竭或死亡。
本次召回涉及更新BiPAP V30, BiPAP A30, BiPAP A40裝置的使用說明,並不包括將終止使用或不再銷售這些產品。FDA已將此次召回確定為最高級別召回。如果不按照更新後的說明使用繼續使用前述裝置,可能導致嚴重受傷或死亡事件。
在進一步評估之後,FDA上周更新了與此次召回事件有關的傷亡人數,目前共有911起報告與召回事件(呼吸機故障報警裝置失效)有關,其中包括894起故障,10人受傷,7人死亡。
前述呼吸機產品主要用於為患有阻塞性睡眠呼吸暫停及呼吸功能不全等其他疾病的成人和符合條件的兒童提供有創或無創支持,具體使用環境有所區別。
記者查詢國家藥監局網站資料庫獲悉,前述三個規格的呼吸機產品中,已有兩款產品在國內獲批。其中,型號規格為BiPAP A40的呼吸機產品於2023年6月12日批準(註冊證編號:國械註進20192082053),另一款型號規格為BiPAP A30的呼吸機產品於2021年5月25日獲批(註冊證編號:國械註進20162085170),兩款產品的註冊人均為偉康股份有限公司(Respironics, Inc.),代理人均為飛利浦(中國)投資有限公司,產品適用範圍/預期用途與FDA釋出的內容相同。
就這兩款呼吸機產品在國內的銷售情況及是否同樣存在故障警報裝置失效、需要召回等問題,7月17日,記者向飛利浦發去采訪提綱,對方表示回復需經總部審批,或在稍後晚些回應。

曾陷召回泥潭
作為全球醫療器械巨頭的飛利浦,曾一度因召回事件陷入泥潭。
據澎湃新聞報道,飛利浦的「召回」風波是從2021年6月開始的。第一份召回通知涉及雙水平氣道正壓通氣 (bi-level PAP)、持續氣道正壓通氣(CPAP)和機械呼吸機裝置,涉及數量約300-400萬台,因為它們存在與聚酯基聚氨酯(PE-PUR)隔音相關的潛在風險,裝置中的泡沫成分可能會對人體產生危害。
2021年7月,FDA將該批次的召回確定為一級召回。一級召回是召回級別中的最高等級,指使用該醫療器械可能或者已經引起嚴重健康危害。據FDA的召回公告,如果用於消除呼吸機聲音和震動的泡沫隨時間的推移開始分解,可能會導致使用者吸入碎片和未經測試的化學物質,進而引起頭痛、外部和內部刺激、哮喘、惡心、對腎臟和肝臟等器官的毒性或致癌作用等癥狀。
隨後,美國和加拿大提起多起集體訴訟,飛利浦開始對召回裝置進行維修和更換。然而2022年1月,FDA將一級召回指定範圍擴大到飛利浦呼吸裝置,飛利浦在接下來的一年裏又多次進行了多次呼吸裝置的召回。
飛利浦呼吸機的召回危機波及中國。2022年6月,中國國家藥品監督管理局接連釋出2則通知,宣布召回飛利浦旗下的無創呼吸機和X射線電腦體層攝影裝置共計28494台。
2023年4月,飛利浦又再次面臨嚴重的召回,涉及其重新設計的DreamStation CPAP裝置。2023年4月底,飛利浦詳細更新了正在進行中的召回數據,據其介紹,4800份最近的投訴是在1-2月收到的,其他的1200份是在3月收到的。在報告中,飛利浦否認傷害和死亡事件是由泡沫分解引起的。「目前,飛利浦尚未發現將這些裝置和死亡案例聯系起來的數據。絕大多數的故障投訴不涉及嚴重的受傷或死亡。」該公司寫道。
多次「召回」給飛利浦帶來了巨大的影響。飛利浦公司2022年財報顯示,2022年飛利浦凈虧損為16.05億歐元,上年同期凈利潤為33.23億歐元;營運收入虧損15.29億歐元,上年同期收入為5.53 億歐元。該公司CFO Abhijit Bhattacharya表示,業績不佳主要受到供應問題、疫情以及呼吸器召回事件帶來的影響。
2022年,飛利浦在全球範圍內進行了兩次裁員,共計裁員1萬人,其中第二次計劃裁員6000人,約一半在2023年執行,其余將在2025年執行。2022年8月,飛利浦宣布,CEO萬豪敦(Frans van Houten)將卸任,其職位由羅伊·雅各布斯(Roy Jakobs)接替,於2022年10月15日生效。雅各布斯已在飛利浦工作超過12年,2021年,他代表飛利浦負責解決呼吸裝置召回問題。
今年1月,持續發酵三年半的飛利浦呼吸機召回事件,最終以多款產品退市收尾。
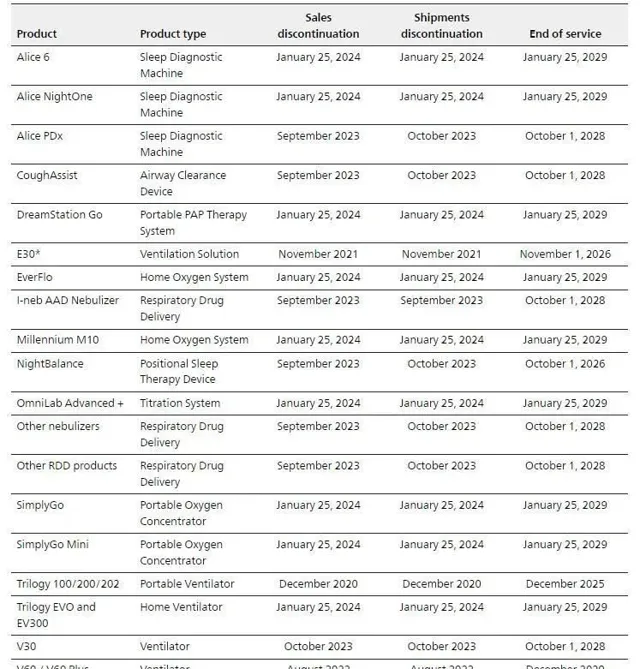
根據飛利浦官網的產品組合更新,在美國,飛利浦偉康將專註於包括面罩在內的耗材和配件的銷售,而不再銷售醫院呼吸機產品、某些家用呼吸機產品、人員攜行式和固定式制氧機以及睡眠診斷產品,其中自2024年1月25日起停售的產品多達9款。

飛利浦主動召回其旗下的
醫用磁共振成像系統
另外,據新華網7月5日報道,近期,國家藥品監督管理局(國家藥監局)官網釋出一則訊息,飛利浦主動召回其旗下的醫用磁共振成像系統(MRI),此次召回級別被定為一級召回,意味著使用該裝置可能或已經導致嚴重健康危害。
根據國家藥監局資訊,飛利浦此次主動召回的醫用磁共振成像系統涉及多個批次,包括國食藥監械(進)字2012第3281132號、國食藥監械(進)字2013第3284026號等產品,這些產品在中國市場共銷售了129台。召回的主要原因是裝置在使用過程中存在安全隱患,如磁體外殼與正交體線圈(QBC)外殼之間的密封條黏合劑可能失效,導致掃描床在進出系統磁體孔時可能對患者造成傷害。
據統計,在過去一年內,飛利浦在國家藥監局官網上共公布了5次主動召回,包括醫用磁共振成像系統、移動式C形臂X射線系統等多種醫療器械。其中,醫用磁共振成像系統成為召回的重點。這些召回行動顯示了飛利浦在發現產品缺陷後的積極態度和迅速響應。
值得註意的是,飛利浦的一級召回並非個例。在主動召回中,有多次被評定為一級召回,涉及醫用磁共振成像系統、單光子發射及X射線電腦斷層成像系統等產品,且這些產品均在國內有售。例如,今年1月,飛利浦因磁共振成像系統磁體外殼與QBC外殼間密封條問題,主動召回了多批次產品,這些產品在國內銷售數量高達925台,主要流向公立醫療機構。
醫療器械召回制度是保障公眾健康安全的重要手段,也是企業履行社會責任的體現。根據【醫療器械召回管理辦法】,醫療器械召回分為一級、二級和三級三個級別,分別對應不同的健康危害程度。一級召回作為最高級別,要求企業在發現嚴重缺陷時立即采取行動,防止危害擴大。
醫藥界人士指出,對於飛利浦等知名企業而言,頻發的召回事件不僅是對企業自身的一次考驗,更是對整個醫療器械行業的一次警示。企業應當以此為契機,加強內部管理,提升產品品質,確保每一件產品都能安全有效地服務於患者。
校對| 孫誌成
每日經濟新聞綜合新京報、澎湃新聞、新華網等
每日經濟新聞
如需轉載請與【每日經濟新聞】報社聯系。











